Die Regionalanästhesie – Das Skript

“There is no body cavity that cannot be reached with a #14G needle and a good strong arm.”
– 6. Regel des House of God (by Samuel Shem)
Jeder Nerv, der mit einer Kanüle oder einem Lokalanästhetikum erreicht werden kann, kann auch anästhesiert werden!
Allgemeiner Teil
Warum Regionalanästhesie?
Regionalanästhesien im Sinne von peripheren Nervenblockaden führen im Gegensatz zu einer Allgemeinanästhesie oder Spinalanästhesie in aller Regel zu keiner Beeinflussung von Kreislauf, Atmung oder Bewusstsein und stellen somit eine schonende und gute Alternative vor allem für Extremitätenverletzungen / Operationen dar. Ein PONV-Risiko besteht generell nicht. Selbst die Einnahme von gerinnungsaktiven Substanzen stellt im Vergleich zur Spinalanästhesie bei den meisten oberflächlichen regionalen Blockaden keine absolute Kontraindikation dar.
Darüber hinaus bietet die Regionalanästhesie den Vorteil einer analgetischen Wirkung, die in aller Regel deutlich über die operative Phase hinaus anhält und daher den postoperativen Gebrauch von systemischen Analgetika (inkl. Opiaten) reduziert. Außerdem gibt es Hinweise darauf, dass sich die Anwendung der Regionalanästhesie positiv auf Phantomschmerzen bei Amputationen auswirkt. Eine mit der Blockade einhergehende periphere Vasodilatation verbessert des Weiteren die Durchblutung und konsekutiv die Wundheilung. Zu guter Letzt scheinen die Risiken für postoperative Komplikationen wie Wundinfektionen nach Hüft-TEP und pulmonale Komplikationen nach Knie-TEP reduziert. [1]
Bei einer reinen peripheren Nervenblockade kann postoperativ häufig auf eine Überwachung im Aufwachraum verzichtet werden. Zudem kann die Nahrungskarenz sofort beendet werden, weil es zu keiner Einschränkung der Schutzreflexe kommt. Dies verringert nicht nur das Auftreten von postoperativer Übelkeit, sondern geht mit einer subjektiven Qualitätsverbesserung des stationären Aufenthalts einher. [2]
Wer profitiert von einer Regionalanästhesie?
So gut wie jeder Patient bzw. jede Patientin kann eine Regionalanästhesie erhalten. Wie bei allen Verfahren sind auch bei einer Regionalanästhesie Vor- und Nachteile gegeben. Letzlich gilt es herauszufinden, wer von den Vorteilen profitiert. Insbesondere bei älteren Patient:innen kann die Verträglichkeit von Allgemeinanästhesien nicht unproblematisch sein. Das Gleiche gilt für kardiopulmonal vorerkrankte Patient:innen. Regionalanästhesien bieten den klaren Vorteil, dass sich keine negative Inotropie während der Narkoseeinleitung ergibt. Viele Operationen lassen sich sogar gänzlich in Regionalanästhesie durchführen, ohne dass eine Beatmung notwendig wird. [3]
Ein Umstand über den man sich im Klaren sein muss, ist, dass Patient:innen mit der Gesamtsituation zurechtkommen sollten; beispielsweise die unterschiedlichen und neuen Eindrücke im OP, die sehr beängstigend wirken können: Hochfrequente Bohr- und Sägegeräusche und das Hämmern in der Unfallchirurgie – in Kombination mit der Erkenntnis, dass gerade an einem selbst operiert wird und dass man die Geräuschquelle nicht zu sehen vermag. Bleibt ein Druck- oder Vibrationsempfinden bestehen (was bekanntermaßen bei Regionalanästhesien vorkommen kann), führt dies oft zu vermeintlichen Schmerzen, Angstreaktionen und sekundären Allgemeinanästhesien. [4]
Letztlich kommt es bei der „Narkoseführung“ einer Regionalanästhesie auf die Patientenführung an. Man muss viel erklären und auf die Patient:innen eingehen, ihnen so gut wie möglich Ängste nehmen und abschätzen, ab wann es ihnen “zu viel” wird. Dieser Prozess beginnt bereits bei der Prämedikationsvisite, in der abgeschätzt werden muss, ob die Patient:innen von ihrer psychischen Konstitution für dieses Verfahren geeignet sind. Hier bietet sich auch die Chance, Ängste durch Erklärungen und professionelles Auftreten zu nehmen. Es sollte mit jeder Patient:in ein individueller Plan erarbeitet werden, welche Maßnahmen ergriffen werden sollen, um die operative Prozedur im Sinne des “best comfort care” zu begleiten – was vom persönlichen Gespräch über selbst mitgebrachte Musik bis zur prozeduralen Sedierung reichen kann. [4]
Auch bei der Sedierung während einer OP kann es zu Problemen kommen. Das eine oder andere Mal triggert man unter Sedierung ein bisher nicht diagnostiziertes obstruktives Schlafapnoe-Syndrom, wobei die Aufwachreaktion mit Bewegungen der Patient:innen zu Unmut bei den Kolleg:innen der Chirurgie führen kann. Ebenfalls sollte der chirurgische Partner/ die chirurgische Partnerin befragt werden, ob der spezifische Eingriff bei diesem Patienten/ dieser Patientin in Regionalanästhesie erfolgen kann. Nicht zuletzt muss auch der Operateur/ die Operateurin auf den Patienten/ die Patientin einwirken, wenn die Entscheidung auf ein regionalanästhesiologisches Verfahren fällt. [5]
Es gibt also viel bei der Durchführung einer Regionalanästhesie zu bedenken. Entscheidend ist jedoch, dass man fast allen Patient:innen mit einer Regionalanästhesie zu helfen vermag. Wenn Anästhesist:in, Patient:in und Operateur:innen dem Verfahren positiv gegenüberstehen, kann der Eingriff gelingen.
Kontraindikationen
Absolut:
– Ablehnung des Verfahrens durch den Patienten/ die Patientin
– Allergie auf Lokalanästhetika (bekannt oder vermutet)
– Zeitkritische Notfallsituation
– Unter Umständen Störung der Blutgerinnung (zentrale/ stammnahe oder rückenmarksnahe Verfahren)
– Infektion im Bereich der Einstichstelle
Relativ:
– Eingeschränkte Kooperations- bzw. Kommunikationsfähigkeit des Patienten / der Patientin
– Sepsis oder SIRS
– Ggf. drohendes oder bestehendes Kompartmentsyndrom
– Lange oder unbequeme Operation und Lagerung (bei alleiniger Anwendung)
– Laparoskopische Eingriffe (bei alleiniger Anwendung)
Nervenschäden
Besteht beispielsweise bei einer Unterarmfraktur ein neurologisches Defizit in Form einer Parästhesie oder Taubheitsgefühl, ist gut überlegen, ob die Vorteile einer Regionalanästhesie überwiegen. Hier ist erneut der Dialog mit den Operateur:innen zu suchen, weil Differenzierungen bei bleibenden Schäden zwischen Traumafolge und iatrogener Genese nur sehr schwierig zu treffen sind. Eine gezielte Anamnese und Dokumentation neurologischer Beschwerden ist vor allem im Dienstgeschehen angezeigt. [6]
Gefahr eines Nervenschadens
Bei elektiven Eingriffen besteht, wenn nicht anders vermerkt, kein erhöhtes Risiko eines Nervenschadens. Sind Zweifel vorhanden, ist Rücksprache mit dem Operateur/ der Operateurin zu halten. Bei dringlichen Eingriffen oder Notfalloperationen im Dienstgeschehen sollte immer Rücksprache mit dem Operateur/ der Operateurin gehalten werden, ob ein erhöhtes Risiko besteht. Es kann sich anbieten, die Zielstrukturen vorab sonographisch darzustellen, um den Schwierigkeitsgrad der Blockade abzuschätzen. [7]
Zwingende Notwendigkeit einer neurologischen oder Funktionsüberprüfung
Besteht eine beschriebene Gefährdung, so ist postoperativ möglichst zeitnah eine Funktionsüberprüfung durchzuführen. Dies ist bei einer vollständig motorisch-sensorischen Blockade nicht möglich und verbietet somit eine Regionalanästhesie. In Rücksprache mit den Operateur:innen können rein sensorische Blockaden zur postoperativen Schmerztherapie in Kombination mit einer perioperativen Allgemeinanästhesie allerdings sinnvoll sein.
Infektion im Anwendungsgebiet
Eine iatrogene Keimverschleppung durch Nadelpenetration ist zu vermeiden. Bei septischen Operationen sollte daher das Interventionsgebiet präzise begutachtet werden – nicht zuletzt deswegen, weil eine Entzündung infolge des sauren Milieus die Wirkung von Lokalanästhetika abschwächen kann. Bei fraglicher faszialer Ausbreitung kann durch eine Sonographie ausgeschlossen werden, dass es im Interventionsgebiet bereits zu einer ödematösen Auftreibung gekommen ist. Axilläre Acne inversa oder andere Befunde sollten immer erkannt und “umgangen” werden. Die Indikation zu einem Verfahrenswechsel zum Beispiel von einer axillären auf eine supraklavikuläre Blockade sollte bei einem Verdacht großzügig gestellt werden. Die wichtigste Infektionsprophylaxe ist eine sichere, gut geplante und einmalig durchgeführte Punktion.
Mangelnde Compliance
Gefährdet die zu behandelnde Person durch ihr Verhalten den Erfolg der Intervention oder gefährdet sie sich sogar aktiv durch Bewegungen während der Anlage, so ist von der Intervention abzusehen beziehungsweise sie ist zu unterbrechen. Liegt die mangelnde Compliance an unzureichender Einsichtsfähigkeit (Kinder, Demenz, etc.), ist oftmals eine leichte Sedierung oder Analgosedierung zielführend. Gerade bei Kindern kann die Regionalanästhesie auch nach der Allgemeinanästhesie erfolgen. Hier ist jedoch vorher sicherzugehen, dass sowohl das Kind als auch die Eltern wissen, dass die Extremität später nicht bewegt werden kann und dieser Zustand reversibel ist. Des Weiteren gibt es den Nachteil, eines fehlenden aktiven Feedbacks bezüglich etwaiger Komplikationen, weshalb diese zu spät erkannt werden können. Es findet sich jedoch keine gesicherte Evidenz, die für oder gegen die Anlage von Regionalanästhesie unter Vollnarkosen spricht. [8]
Fehlende Aufklärung, mutmaßliche Einwilligung
Fand bei elektiven Eingriffen keine Aufklärung über eine Regionalanästhesie statt, ist diese Maßnahme nicht durchzuführen.
In lebensbedrohlichen Situationen besteht aber häufig keine Zeit für eine Regionalanästhesie, wie wir sie als elektives Konzept zur postoperativen Analgesie bevorzugt durchführen. Starke Schmerzen stellen jedoch einen Notfall dar, sodass im Rahmen einer mutmaßlichen Einwilligung sogar ohne Aufklärung eine Regionalanästhesie durchgeführt werden kann. Eine Aufklärung des Patienten/ der Patientin ist jedoch (aus juristischen Gesichtspunkten) zu bevorzugen und sollte idealerweise wenigstens nachgeholt werden. [4]
Ein sehr gutes Beispiel für diese Situation ist eine Notfall-Laparotomie, bei der kein Periduralkatheter gelegt werden konnte. Sollten die Patient:innen postoperativ starke Schmerzen haben, eignet sich ein TAP-Block (Transversus-abdominis-plane-Block) sehr gut, um eine Schmerzlinderung zu erzielen.
Ist ein Patient/ eine Patientin nicht aufklärungsfähig, obliegt die Wahl des adäquaten Anästhesieverfahrens bei dem oder der durchführenden Anästhesisten/ Anästhesistin. Entsprechend kann auch hier eine Regionalanästhesie durchgeführt werden, wenn es sich um das bestmögliche Verfahren handelt. [4]
Wird durch eine chirurgische Abteilung eine Notfallindikation für eine Operation gestellt, so ist dies durch eine Unterschrift der Chirurg:in zu dokumentieren, insbesondere wenn die Patient:innen nicht aufklärungsfähig sind.
Physiologie
Wie so häufig in der Anästhesie, holt uns das Wissen aus der Vorklinik ein. Es gibt unterschiedliche Nervenfasern mit unterschiedlichen Aufgaben, die sich daher anatomisch unterscheiden. Der hauptsächliche Unterschied liegt in der Dicke der Myelinschicht um den Nerv, was die Nervenleitgeschwindigkeit beeinflusst. Die meisten werden sich an die Einteilung nach Erlanger und Gasser erinnern, dass die Aα-Fasern für die Willkürmotorik zuständig und am dicksten myelinisiert sind. Es folgen die Aβ-Fasern für Hautrezeptoren, Aδ-Fasern für Temperatur und schnelles Schmerzempfinden, B-Fasern für viszerale Empfindungen und C-Fasern ebenfalls für viszerale Empfindungen und zusätzlich auch für langsames Schmerz- und Temperaturempfinden. [9]
| Fasertyp | Leitungsgeschwindigkeit (m/s) | Durchmesser (µm) | Funktion |
| A𝛼 | 70-120 | 10-20 | Skelettmuskeln (extrafusal), Efferenzen aus Muskelspindeln und Golgi-Sehnenorgane |
| A𝛽 | 30-70 | 7-15 | Berührung, Druck, Vibration |
| A𝛾 | 15-30 | 4-8 | Skelettmuskeln (intrafusal) |
| A𝛿 | 12-30 | 2-5 | Temperatur, schneller Schmerz |
| B | 3-15 | 1-3 | präganglionäre Viszeroefferenzen |
| C | 0,5-2 | 0,1-1,5 | postganglionäre Viszeroefferenzen, langsamer Schmerz, Thermorezeptoren |
Darstellung der Nervenfasereinteilung nach Erlanger und Gasser [9]
Eine einfache, gleichwohl grundlegend erklärungsbedürftige Tatsache ist, dass Lokalananästhetika (LA) längere Zeit benötigen, um durch eine dicke Myelinschicht zu diffundieren als durch eine dünne. Entsprechend ist nach dem Spritzen des LA nicht direkt die Muskulatur bewegungsunfähig, sondern der Block breitet sich langsam aus. Als Erstes werden vegetativen Nervenfasern blockiert. Dies führt zu einer Vasodilatation im betroffenen Gebiet und daher auch zu einer Erwärmung. Bereits danach werden die C-Fasern und nach und nach die dicker myelinisierten Nervenfasern betäubt. Je nach LA dauert es kürzer oder länger, bis die Wirkung eintritt. Erst nach einem Ausfall der Sensorik, fällt die zugehörige Motorik aus. Man kann also davon ausgehen, wenn die Zielmuskeln der Nerven nicht mehr bewegt werden können, dass ebenfalls eine Analgesie im Zielgebiet vorliegt. Ein wichtiger Punkt, auf den man in der Praxis immer wieder stößt, ist, dass trotz ausreichender Analgesie Druck oder Vibration empfunden werden. Auf diesen Umstand müssen Patient:innen vorbereitet werden, da diese Empfindungen sonst als Schmerz fehlinterpretiert werden können. [10, 11]
Um den Wirkungseintritt der Regionalanästhesie abzuschätzen, behelfen sich viele Kolleg:innen folgendermaßen: Sie besprühen die Zielstelle mit alkoholischem Desinfektionsmittel und überprüfen, ob die Patient:innen die Verdunstungskälte im Vergleich zur Gegenseite spüren können. Da Temperatur- und Schmerzempfinden über die gleichen Nerven verschaltet sind, ist davon auszugehen, dass bei fehlendem Kälteempfinden auch eine Analgesie vorliegt. Dies ist insbesondere auch bei Spinal- und Periduralanästhesien von Interesse, wenn man die Höhe der Ausbreitung ermitteln möchte. [12]
Das mag zunächst für den Einstieg reichen – aber wie funktioniert nun die Reizweiterleitung an den einzelnen Nervenfasern?
Die Myelinschicht ist, egal wie dick diese bei den unterschiedlichen Nervenfasertypen ausgebildet ist, nicht durchgängig. Sie wird in regelmäßigen Abständen (ca. alle 0,1-1,5mm) durch sogenannte Ranvier’sche Schnürringe unterbrochen. Diese finden sich anatomisch dort, wo zwei myelinbildende Schwann-Zellen am Axon aufeinander treffen. An diesen Schnürringen befinden sich spannungsabhängige Natriumkanäle. Die Myelinschicht wirkt wie eine Isolierung. Wird an dem Nerv ein Reiz ausgelöst, kommt es zur Depolarisierung der Natriumkanäle. Da die Myelinisierung isolierend ist, findet auf diesen Strecken keine Depolarisierung statt, sondern erst wieder an den Natriumkanälen im Bereich der Schnürringe, sodass die Erregung von einem Ranvier’schen Schnürring zum nächsten springt. Man spricht von der sogenannten saltatorischen Erregungsleitung. Durch die Unterbrechung dieser Erregungsleitung wirken Lokalanästhetika. Dies wird im Folgenden näher erläutert. [13]
Lokalanästhetika
Im Wesentlichen gibt es zwei Klassen von Lokalanästhetika (LA): die Aminoester- und die Aminoamid-LA. Die Aminoester-LA zerfallen durch hydrolytischen Abbau im Plasma zu Paraaminobenzoesäure. Aus diesem Grund führen sie häufiger zu allergischen Reaktionen und werden heutzutage seltener eingesetzt. Aminoamid-LA werden in der Regel über die Leber enzymatisch abgebaut, was bei Lebererkrankungen zu Problemen führen kann. [14]
Infolge der unterschiedlichen chemischen Zusammensetzungen der Lokalanästhetika kommt es, wie bei anderen Medikamenten auch, zu unterschiedlicher analgetischer Potenz, unterschiedlicher Zeit bis zum Wirkeintritt, unterschiedliche Wirkdauer und relativen Toxizitäten (Grundsubstanz ist Lidocain).
| Lokalanästhetika | analgetische Potenz | Wirkbeginn | Wirkdauer | relative Toxizität |
| Lidocain | mittel (2) | schnell | mittel | 1 |
| Mepivacain | mittel (2) | schnell | mittel | 1 |
| Prilocain | mittel (2) | schnell | mittel | 0,5 |
| Bupivacain | hoch (8) | langsam | lang | 4 |
| Ropivacain | hoch (6-8) | mittelschnell | lang | 2 |
Übersicht über verschiedene Lokalanästhetika [14]
Hieraus ergeben sich unter anderem die unterschiedlichen Maximaldosen:
| Lokalanästhetika | Maximaldosis |
| Lidocain | 3-4mg/kg |
| Mepivacain | 4mg/kg |
| Prilocain | 5-6mg/kg |
| Bupivacain | 2mg/kg bzw. 0,4mg/kg/h kontinuierlich |
| Ropivacain | 3-4mg/kg bzw. 37,5mg/h kontinuierlich |
| Chlorprocain (LA vom Estertyp) | 11mg/kg (max. 800mg) |
Maximaldosen verschiedener Lokalanästhetika [14]
Wirkweise Lokalanästhetika:
An den spannungsabhängigen Natriumkanälen der Neuronen setzen die gängigen Lokalanästhetika an. Sie blockieren durch reversible intrazelluläre Bindung an die alpha-Untereinheit der spannungsabhängigen Natriumkanäle den Natriumeinstrom und somit die Depolarisierung. Dies führt zu einer Unterbrechung der Erregungsweiterleitung und damit zur nicht Wahrnehmung des Reizes. Der intrazelluläre Bindungsort an den Ionenkanälen und die dafür nötige passive Diffusion durch die Lipidmembran der Zellen hat zur Folge, dass die Potenz eines Lokalanästhetikums von seiner Lipidlöslichkeit abhängt. Die Tatsache, dass Lokalanästhetika in einer dissoziierten (wasserlösliches Kation) und einer nicht dissoziierten (lipidlösliche Base) Phase vorliegen, führt in “saurem” entzündlichem Gewebe dazu, dass die Konzentration der lipidlöslichen Base zu niedrig ist, und somit keine ausreichende Menge an LA in die Nervenzellen eindringen und die Natriumkanäle blockieren kann. [14]
Auch weitere Kanäle, wie z. B. Kalium-Kanäle, werden von den LA blockiert. Diese fällt aber deutlich geringer als bei den Natriumkanälen aus – erklärt aber die potenziell möglichen systemischen Wirkungen.
Nerven- oder Flächenblockade
Hier erklärt sich das “oder” aus dem Zitat vom Anfang. Einige Nerven sind so groß, dass sie gut im Ultraschall dargestellt werden können. Hier ist es in der Regel kein Problem, die Nadelspitze gezielt zum Nerven zu führen und ihn mit LA zu umspülen, z. B. bei axillären Plexusblockaden oder beim distalen N. ischiadicus Block. Bei kleineren Nerven sieht das anders aus.
Bei manchen kann man sich aber die Anatomie zunutze machen. Kennt man die anatomischen Verhältnisse und weiß, in welcher Faszie und zwischen welchen Muskeln die Nerven verlaufen, reicht es, diese Faszie im Ultraschall aufzusuchen und mit einer größeren Menge an LA aufzuspritzen. Das Medikament kann gar nicht anders, als die Nerven zu umspülen und zu betäuben.
Bei der Anlage einer Regionalanästhesie ist auf eine ausreichende und dem Block angepasste Menge an Lokalanästhetikum zu achten. Im Rahmen einer axillären Plexusblockade kann durch eine große Menge LA (CAVE Maximaldosis) eine sichere Umspülung der Nerven erzielt werden, auch wenn grundsätzlich die gezielte Betäubung der einzelnen Nerven möglich ist. Im Gegensatz dazu bedingt die Blockade der zervikalen oder interskalenären Nervenstrukturen eine Limitierung der Lokalanästhetikamenge, da in unmittelbarer Nähe auch die Nervenstrukturen des Nervus phrenicus verlaufen. Man darf sich hier nicht von falschem Ehrgeiz leiten lassen, arbeitet man doch für die Patientin oder den Patienten. Sind die Strukturen sonografisch nicht gut darstellbar und ist an der geeigneten Stelle die Injektion einer größeren Menge LA möglich, sollte man dies wahrnehmen, um eine gute Wirkung zu erzielen.
Das bezieht sich aber insbesondere nicht auf Blöcke im Halsbereich! Hier ist so wenig Raum, dass sich das LA in größeren Mengen zwingend umverteilt und Nebenwirkungen hervorruft, da noch andere Nerven betäubt werden (N. Vagus, N. phrenicus oder sympathische Nerven des Grenzstrangs).
Aufklärung
Die rechtssichere Aufklärung über medizinische Maßnahmen (gemäß § 630e BGB) ist ein Thema, welches viele Stunden füllen kann. Selbstverständlich ist auch die Durchführung einer Regionalanästhesie aufklärungspflichtig. Hier sollen die allgemeinen Inhalte dieser Aufklärung besprochen werden. Die speziellen Komplikationen, die einige Verfahren mit sich bringen, werden bei den einzelnen Blockaden aufgeführt und gehören natürlich auch zur Aufklärung.
Auch wenn eine mündliche Aufklärung prinzipiell ausreichend ist, bietet es sich an, das Aufklärungsgespräch auf einem individualisierten Aufklärungsbogen zu dokumentieren. Hier wird normalerweise auch die Einwilligung der Patient:innen durch ihre Unterschrift dokumentiert. Individualisiert bedeutet in diesem Fall, dass auf dem standardisierten Bogen durch Markierungen und handschriftliche Ergänzungen das besondere individuelle Risiko durch das gewählte Verfahren für die jeweilige Person ersichtlich wird.
Zu den allgemeinen Risiken gehören:
– Infektion
– Allergische Reaktion
– Gefäßverletzung mit Hämatombildung
– Nervenverletzung
– Systemische Wirkung von Lokalanästhetika, insbesondere bei intravasaler Lage von Kathetern
– unzureichende Analgesie mit sekundär notwendiger Allgemeinanästhesie
– Es ist auf die betroffene Extremität besonders zu achten, da durch die Betäubung ein erhöhtes akzidentelles Verletzungsrisiko besteht
Je nach Patient:in bietet es sich an, die Risiken anhand des Ablaufs der Regionalanästhesie zu erklären. Hierbei lassen insbesondere bei ängstlichen Patient:innen einige Risiken relativieren, indem darauf hingewiesen wird, dass Nervenverletzungen sehr selten sind, da man im Ultraschallbild genau sehen kann, wo sich die Nadel befindet. Treten Nervenverletzungen wider erwarten dennoch auf, sind sie in der Regel transient und rufen keine bleibenden Schäden hervor.
Zwingender Teil der Aufklärung muss die Allgemeinanästhesie sein. Das Versagen der Methode kann trotz bestmöglich durchgeführter Regionalanästhesie vorkommen und somit ihre Wirkung nicht ausreichend sein. In diesem Fall stellt die Allgemeinanästhesie stellt immer eine Rückfallebene dar, weshalb Patient:innen auch für eine Regionalanästhesie nüchtern sein müssen. [4]
Unser Regionalanästhesiekonzept in Bremerhaven
In Gesprächen mit verschiedenen Kolleg:innen aus dem gesamten Bundesgebiet wurde uns immer wieder berichtet, die Durchführung von Regionalanästhesien in ihren Häusern sei äußerst problematisch. Häufig werden sie gerade von chirurgischer Seite als Verzögerung gesehen und daher boykottiert.
Führt man natürlich erst im Einleitungsraum eine Regionalanästhesie durch, der sich dann noch eine Allgemeinanästhesie anschließt oder nach der man noch auf einen adäquaten Wirkeintritt warten muss, kostet das Zeit!
Wir möchten dies zum Anlass nehmen, um unsere Abläufe einmal zu erläutern und so eine Prozessoptimierung vorzuschlagen und die tiefgreifenden Vorteile der Regionalanästhesie, wie längere Analgesie, geringerer Opiatverbrauch, flache Narkose, kürzere Aufwachzeit, etc. ausnutzen zu können.
Rein strukturell besteht das höchste Aufkommen an Regionalanästhesien in der Unfallchirurgie, welche bei uns zwei bis drei OP-Säle pro Tag betreiben. Im besten Fall stehen also direkt morgens zwei Regionalanästhesien an. Damit diese bis zum vereinbarten OP-Beginn durchgeführt worden sind, fängt ein Assistenzarzt/ eine Assistenzärztin eine halbe Stunde früher an. In der Regel ist der entsprechende Kollege/ die entsprechende Kollegin gerade in seiner/ ihrer Rotation für Regionalanästhesie für mehrere Wochen am Stück eingeteilt, um die entsprechenden Verfahren zu erlernen. Die Patient:innen werden bei uns in eine „Holding Area“ bestellt, die rein räumlich Teil des Aufwachraums ist. Hier werden bis auf ein paar Ausnahmen alle Regionalanästhesien durchgeführt. Insbesondere am Morgen werden die entsprechenden Kolleg:innen durch Fach- oder Oberärzt:innen begleitet, die die Kolleg:innen je nach Ausbildungsstand beaufsichtigen und ausbilden. Den restlichen Tag über ist der Kollege/ die Kollegin für einen Saal und für die übrigen Regionalanästhesien verantwortlich. Steht eine Regionalanästhesie an, muss der Patient/ die Patientin rechtzeitig bestellt werden, sodass der Kollege/ die Kollegin genug Zeit zur Verfügung hat. Er/ Sie wird dann von einer Anästhesiepflegekraft oder einem Anästhesisten/ einer Anästhesistin ausgelöst, damit er/ sie in Ruhe die Regionalanästhesie durchführen kann. Sollte der Kollege/ die Kollegin nicht verfügbar sein, gibt es bei uns genug erfahrene Kolleg:innen, die stattdessen die benötigte Regionalanästhesie durchführen können. Dies hat den weiteren Vorteil, dass auf dem kurzen Dienstweg Kolleg:innen um Hilfe gebeten werden können, die dann hilfreich mit “Tipps und Tricks” zur Seite stehen. Aus eigener Erfahrung hat man zu Beginn der regionalanästhesiologischen Lernkurve häufig das Bedürfnis, dass eine erfahrene Person mit auf den Bildschirm schaut und bei der Identifikation der Zielstrukturen unterstützt. Das System hat sich bei uns zu einem Selbstläufer entwickelt und eine gewisse Selbstverständlichkeit erlangt. [15]
Die postoperative Betreuung etwaiger Schmerzkatheter wird bei uns von einer Gruppe Pain-Nurses übernommen, die Teil unserer Schmerzklinik sind.
Die wichtigsten Punkte:
– Rotation für Regionalanästhesie
– Regionalanästhesie-Dienst 30 Minuten früher
– Patient:innen werden rechtzeitig bestellt
– Regionalanästhesien werden in der Holding Area vom Regional-Dienst durchgeführt
Standards in der Patient:innenvorbereitung
Einer unserer Anästhesiepfleger (an dieser Stelle vielen Dank an Herrn Gerdes) hat vor einiger Zeit ein Konzept zur Patientenvorbereitung erarbeitet und durchgesetzt. So kommen alle elektiven Patient:innen mit einer auf der Station gepackten OP-Mappe in unsere Holding Area. In dieser Mappe sind das Anästhesieprotokoll, die chirurgische Aufklärung, die anästhesiologische Aufklärung, das letzte Labor des Patienten/ der Patientin, die WHO-Checkliste für die OP und die ausgefüllte Vorbereitungscheckliste der Station enthalten. So hat man gleich alle relevanten Unterlagen zusammen. Noch zeitgemäßer wäre natürlich eine digitale Patientenakte.
WHO-Checkliste
Die WHO-Checkliste ist bekanntermaßen untergliedert in einen präanästhesiologischen Teil, das Team Timeout vor OP-Beginn und einen postoperativen Teil. Den maßgeblichen präanästhesiologischen Teil erledigt bei uns im Regelfall die Anästhesiepflege. Sie identifiziert die einzelnen Patient:innen, lässt sich die geplante Operation bestätigen, fragt noch einmal nach Allergien, überprüft die unterschriebenen Aufklärungen und ob eine Markierung stattgefunden hat. Des Weiteren erfolgt hier die erneute Einwilligung in das geplante Anästhesieverfahren und in die Operation. Anschließend wird noch ein intravenöser Zugang gelegt, falls noch keiner vorhanden ist, und die Antibiotikaprophylaxe wird zeitgerecht verabreicht. Vor der Narkoseeinleitung überprüft der/ die zuständige Anästhesist:in diesen Teil der Checkliste noch einmal auf Vollständigkeit. In der Regel wird er/sie zur Begutachtung des Patienten/ der Patientin von der Saalpflegekraft vorab ausgelöst, sodass er den Patienten/ die Patientin noch einmal bezüglich etwaiger Schwierigkeiten und Risiken beurteilen kann. Ein internes TEAM TIME OUT (richtige/r Patient:in (insbes. bei Holding areas), richtiger Block, richtige Seite) sollte zwischen Anästhesist:in und begleitender Pflegekraft vor jeder Regionalanästhesie, zum Beispiel beim Beziehen des Schallkopfes mit der sterilen Schutzfolie, erfolgen.
Erneute Einwilligung in das geplante Anästhesieverfahren und in die Operation
Dieses Thema ist aktuell Teil der juristischen Diskussion. Das Oberlandesgericht Bremen hat im November 2021 entschieden, die Unterschrift eines Patienten nach einem Aufklärungsgespräch sei der Einwilligung in das Narkoseverfahren gleichzusetzen (Urteil vom 25.11.2021 – 5 U 63/20, MedR 2022, 493 ff.). Die Einwilligung in ein Verfahren müsse nach einer an der Dringlichkeit gemessenen Bedenkzeit erfolgen. Der Anästhesist/ die Anästhesistin sei verpflichtet, den/ die Patient:in vor Beginn der Anästhesie noch einmal nach der Einwilligung in die geplante Prozedur zu fragen. Das Urteil wurde allerdings vom Bundesgerichtshof mit Urteil vom 20.12.2022 (AZ: VI ZR 375/21, NJW 2023, 1435 ff.) aufgehoben und die Sache zur erneuten Entscheidung an das Oberlandesgericht Bremen zurückverwiesen. Zur Begründung seiner Revisionsentscheidung führte der BGH im Wesentlichen aus, § 630e sehe keine von der Einwilligung einzuhaltende “Sperrfrist” vor, deren Nichteinhaltung zur Unwirksamkeit der Einwilligung führen würde.
Zum Zeitpunkt der Veröffentlichung unseres Manuskripts liegt noch keine weitere Entscheidung des OLG Bremen vor. Wir werden natürlich darüber berichten, sobald eine Entscheidung ergangen ist. Es ist jedoch anzunehmen, dass keine Auswirkung auf unseren gewohnten Ablauf bezüglich der Aufklärung elektiver Patient:innen zu erwarten ist.
Erläuterung des Procedere
Häufig sind wir bei der Durchführung von Regionalanästhesien auf die Mithilfe der Patient:innen angewiesen, weshalb mit ihnen das geplante Procedere besprochen werden sollte. Diese Vorgehensweise nimmt Patient:innen die Angst, uns ausgeliefert zu sein und erhöht die prozedurale Compliance. Wichtig ist, dass die einzelnen Patient:innen insbesondere vor schmerzhaften Schritten, wie beispielsweise der Bewegung einer verletzten Extremität oder aber vor dem Stich, gewarnt werden. Der Bildschirm des Ultraschallgerätes eignet sich gut, um die Patient:innen abzulenken und ihnen das Vorgehen zu erklären. Über kompetente und nachvollziehbare Aussagen des Ablaufs der Blockade lässt sich häufig eine Verstärkung der Patientencompliance und eine Angstreduktion erzielen.
Monitoring
Auch während der Durchführung einer Regionalanästhesie ist ein Standardmonitoring aus EKG, Pulsoxymetrie und nicht-invasiver Blutdruckmessung anzulegen. Durch unser Vorgehen können verschiedene Nebenwirkungen hervorgerufen werden: Von der intravasalen Gabe der Lokalanästhetika bis zur kurzzeitigen Asystolie durch einen Vagusreiz, der durch den Einstich ausgelöst wird. Ist es notwendig, das Gesicht mit einem Lochtuch abzudecken, beispielsweise bei einem interskalenären Katheter, ist unter anderem auch bei Beklemmungsgefühlen der Patient:innen eine Sauerstoffgabe indiziert.
Anxiolyse/ Analgosedierung
Die präoperative Gabe von Benzodiazepinen zur Anxiolyse ist mittlerweile keine gängige Praxis mehr. Sie wird allenfalls in Einzelfällen oder in enger Absprache mit den Patient:innen gegeben. Kurz vor der Regionalanästhesie in der Holding Area, können einige Patient:innen ausgeprägte Stressreaktionen zeigen. Hier ist die Überlegung angebracht, ob beispielsweise die Gabe von Sedativa vor der Regionalanästhesie vorteilhaft ist. Die Stressreduktion hilft nicht nur den Patient:innen, sondern kann durch eine gesteigerte Compliance auch uns die Arbeit erleichtern. Das Gleiche gilt für eine Analgesie. Die Lagerung des Patienten/ der Patientin ist das A und O bei der Regionalanästhesie. Viele Patient:innen, bei denen wir Blöcke stechen oder Katheter legen, sind durch ein Trauma oder Arthrose eingeschränkt. Wir sind dennoch auf ihre Mitarbeit angewiesen, da sie die betroffene Körperregion ruhig halten und in dieser Position verharren müssen, um unsere Arbeit bestmöglich erledigen zu können. Es sollte also zumindest erträglich für die Patient:innen sein. Bei den einzelnen Blöcken werden jeweils Lagerungsbeispiele abgebildet.
Standards in der Materialvorbereitung
Man muss im Vorhinein das notwendige Material vorbereiten. Zudem stellen sich in diesem Zeitpunkt noch folgende Fragen: Was wird alles benötigt? Warum mache ich die Regionalanästhesie überhaupt? Benötige ich eine Wirkung über Tage oder reicht eine kurze Betäubung für einige Minuten aus?
Set Up Single-Shot
– Steriler Ultraschallbezug
– Nadel mit Reflexverstärkung für Ultraschall
– Perfusorleitung
– Haube
– Sterile Handschuhe
– 20 ml Spritze
– Lokalanästhetika (bei uns Standardmischung aus 10 ml Lidocain 2 % und 10 ml Ropivacain 0,75 %)
– Hautdesinfektionsmittel
– Tupfer nach Bedarf
Set Up Katheterverfahren
Links im Bild: Material für eine Katheteranlage
– Basisset Anästhesiologie für SPA, PDK und Schmerzkatheter:
o 1x Plastikschale mit 4x Kugeltupfern
o 1x Plastikklemme
o 1x Lochtuch
o 1x Spritze 2 ml für Lokalanästhesie
o 1x Spritze 5 ml für intrathekale Applikationen
o 1x Spritze 10 ml für die PDK-Anlage
o 1x Aufziehkanüle
o 1x subkutan Kanüle
o 1x intramuskuläre Kanüle
o 2x Kugeltupfer
– Katheterset:
o 1x Tuohy-Nadel 9 cm mit NRfit Anschluss (vermeidet akzidentelle Injektionen mit herkömmlichen Luer-Lock Systemen)
o 1x Katheter mit Einführhilfe
o 1x Verbindungsaufsatz NRfit mit Einrastfunktion
o 1x Filter mit NRfit Anschluss
o 10 ml Spritze NRfit
– Steriler Kittel
– Sterile Handschuhe
– Haube
– Hautdesinfektionsmittel sowohl zum Sprühen als auch Wischen
– 20 ml NRfit Spritze
– NRfit Kanüle
– NRfit Leitung
– Steriles Ultraschallgel
– Nadelhalter
– Schere
– Annaht oder Alternativen, wie Dermabond
– Lokalanästhetika (bei uns Standardmischung aus 10 ml Lidocain 2 % und 10 ml Ropivacain 0,75 %)
– Ggf. Material für einen zusätzlichen Single-Shot
Hygiene in der Regionalanästhesie [30]
Anmerkung: Eine ausführliche Ausarbeitung dieses Themas bietet die S1-Leitlinie Hygieneempfehlungen für die Regionalanästhesie. Für unser Skript beschränken wir uns in diesem Kapitel auf die wesentlichen Aussagen und verweisen auf unsere Handlungsempfehlungen im Text selbst.
Neben den allgemein bekannten Hygieneregeln, wie einer korrekt durchgeführten Händedesinfektion und dem Tragen eines Mund-/Nasen-Schutzes sowie einer Kopfhaube – was sowohl für das medizinische Personal als auch für unsere Patient:innen gilt -, müssen weitere Maßnahmen zur Vorbeugung einer Kontamination/Infektion getroffen werden.
Es erscheint sinnvoll, dass eine – ungefärbte – remanenzhaltige (Chlorhexidin, Octenidin aber auch PVP-Jod) alkoholbasierte Lösung als Desinfektionsmittel genutzt wird. Für einzeitige periphere Punktionen kann eine gründliche Sprühdesinfektion unter Beachtung der Einwirkzeit als ausreichend angesehen werden.
Sterile Abdecktücher bzw. -folien
Bei neuroaxialen Verfahren oder peripheren Katheteranlagen sind sterile Abdecktücher und sterile Arbeitsflächen unabdingbar, um eine Kontamination des Punktionsgebietes zu vermeiden.
Bei einer einzeitigen peripheren Regionalanästhesie sind Abdecktücher und sterile Ablageflächen zur Infektionsprävention nicht notwendig und sowohl aus ökologischer als auch ökonomischer Sicht zu vermeiden.
Sterile Handschuhe und steriler Kittel
Bei der Durchführung neuroaxialer Punktionen müssen zwingend sterile Einmalhandschuhe verwendet werden. Handelt es sich um ein kontinuierliches Verfahren (PDK, periphere Katheteranlagen) ist auch die Verwendung eines sterilen Kittels angezeigt. Bei einzeitigen Injektionen – insbesondere der Spinalanästhesie – kann auf einen sterilen Kittel verzichtet werden.
Bei einzeitigen peripheren Punktionen bzw. Injektionen ist auch das Tragen von sterilen Handschuhen – sofern eine adäquat durchgeführte hygienische Händedesinfektion des med. Personals stattgefunden hat – nicht vonnöten. Eine Verwendung von medizinischen Einmalhandschuhen ist bei Durchführung der sog. „non-touch-Technik“ ausreichend. (Bei der „non-touch-Technik“ wird der Kontakt der unsterilen Hände mit der desinfizierten Punktionsstelle sowie dem sterilen Kanülenteil, welches die Haut penetriert, sicher vermieden.)
Hygiene im Hinblick auf ultraschallgesteuerte Punktionen
Bei neuroaxialen Verfahren und peripheren Kathetertechniken muss ein steriler Ultraschall-Überzug verwendet werden, um eine Kontamination der sterilen Flächen zu vermeiden.
Bei bestimmten einzeitigen peripheren Blockaden mit größerem Abstand von Ultraschallkopf
und Einstichstelle kann ggf. auf die Verwendung eines sterilen Schallkopfüberzuges verzichtet werden („no-touch-Techniken“).
Dies ist allerdings nur unter konsequenter Desinfektion des Schallkopfes vor und nach der
Punktion sowie sicherem Umgang mit Punktionsnadel und Schallkopf ohne
Kontaminationsrisiko akzeptabel. (Zitat aus der S1-Leitlinie Hygieneempfehlungen für die Regionalanästhesie)
Antibiotikaprophylaxe
Eine Antibiotikaprophylaxe zur Anlage einer Regionalanästhesie ist auch bei einem Katheterverfahren nicht sinnvoll. Allerdings kann eine perioperativ geplante Antibiotikaprophylaxe (PAP) auf den Zeitpunkt der Anlage der Regionalanästhesie vorverlegt werden. Prospektive klinische Untersuchungen zu diesem Vorgehen fehlen allerdings zum aktuellen Zeitpunkt noch.
Sonographisch gesteuerte Punktion
Physik
Schall ist eine sich bewegende Änderung des Drucks in einem Medium. Diese Änderungen breiten sich wellenförmig in einem Medium aus, wodurch sie Druckerhöhungen und -verminderungen erzeugen.
Ein Zyklus beschreibt den Komplex aus einer Druckerhöhung und einer darauf folgenden Druckverminderung. Die Dauer eines Zyklus (ms) heißt Periode. Der Abstand zwischen zwei Amplituden ist die Wellenlänge (λ, mm). Die Anzahl der Zyklen pro Sekunde wird in Hertz (Hz) gemessen.
Ultraschall bewegt sich oberhalb der vom Menschen wahrnehmbaren Frequenzen (f) von 20.000 Hz.
Die Ausbreitungsgeschwindigkeit (c) ist abhängig vom Medium (Luft 330 m/s (Schallgeschwindigkeit), Wasser 1500 m/s) und wird für den Menschen zur Vereinfachung mit der von Wasser gleichgesetzt.
Die Wellenlänge ist proportional zur Ausbreitungsgeschwindigkeit und umgekehrt proportional zur Frequenz.
Die Wellenlänge kann als Maß für die Auflösung des Ultraschallgeräts gesehen werden. Bei einer großen Wellenlänge besteht die Gefahr, dass sie an einer Struktur vorbeiläuft und diese somit nicht angezeigt wird.
Sehr hochfrequente Schallköpfe wie der Linearschallkopf haben eine hohe Auflösung, aber eine geringe Eindringtiefe.
Niedrigfrequente Schallköpfe wie der Sektorschallkopf haben eine große Eindringtiefe, dafür aber eine schlechtere Auflösung.
Also bietet es sich an, die höchste Frequenz auszuwählen, die trotzdem mit einer adäquaten Eindringtiefe einhergeht.
Die Sonografie ist mit der Arbeit der beiden Gebrüder Jaques und Pierre Curie verbunden. Bereits im Jahr 1880 beobachteten sie den Effekt, dass bei Druckausübung auf bestimmte kristalline Strukturen (Piezokristalle) eine Spannung messbar ist. Folgendes konnte man auf Grundlage dieser Beobachtung einige Jahre später beschreiben: Wird an einen Piezokristall eine Wechselspannung angelegt, kommt es zur Erzeugung von Wellen in der gleichen Frequenz wie die angelegte Spannung. Der Schall im Ultraschallgerät wird durch diesen piezoelektrischen Effekt erzeugt. Piezokristalle können also sowohl Schall bilden als auch empfangen. Die Änderung der Oberfläche durch den Schalldruck erzeugt ein messbares elektrisches Signal. Die Kristalle befinden sich abwechselnd im Sende- und Empfangsmodus.
Anhand der Laufzeit (t) kann die Entfernung eines Objekts zum Schallkopf (D) mittels Ultraschall bestimmt werden, da die Ausbreitungsgeschwindigkeit (c) bekannt ist.
Je mehr Schall zurückkommt, desto höher ist die Amplitude des gemessenen Signals. Das Bild aus diesen „Rohdaten“ heißt A-Bild (Amplitude) und spielt inzwischen kaum eine Rolle mehr. Heutzutage wird jeder Amplitude ein Wert auf einer Skala zugeordnet und mit Farbe kodiert. Entlang einer Schallwelle werden die Amplituden als Farbe dargestellt. Das hieraus entstehende Bild wird B-Bild (Brightness) genannt. Als letztes gibt es noch den M-Mode (Motion). Er ist für die Regionalanästhesie nicht relevant, soll aber der Vollständigkeit halber erwähnt werden. Hierbei wird entlang einer im B-Bild eingestellten Linie diese über die Zeit abgebildet, sodass Bewegungen von Strukturen dargestellt werden können.
Schall wird nur von Objekten reflektiert, die größere Dimensionen haben als die Wellenlänge. Kleinere Strukturen (meist Erythrozyten) erzeugen lediglich eine Streuung.
Ein Teil der Wellen geht durch Streuung verloren. Der Streuungseffekt wird jedoch für Dopplermessungen benötigt.
Artefakte
Reverberationen
Bei Reverberationen kommt es zu einer vermeintlichen Vermehrung einer Grenzlinie, was insbesondere vorkommt, wenn die Schallwellen im 90° Winkel auf eine Struktur mit parallelen Grenzflächen fallen. Häufig ist dies bei den von uns benutzten Nadeln zu sehen, mit denen wir Regionalanästhesien durchführen. Die Schallwellen durchdringen eine Wand der Nadel, wobei ein Teil zum Schallkopf zurückgeworfen wird. Im Hohlraum der Nadel wird der Schall an der Gegenseite zu einem Teil reflektiert und erneut in Richtung Schallkopf zurückgeworfen. Kommen die Wellen wieder an der ersten Wand an, wird hier wieder ein Teil reflektiert. Die Wellen sind gleichsam in der Nadel gefangen und gelangen nur zum Teil durch sie hindurch. Der Schallkopf wiederum misst nur die Laufzeit der Schallwellen und erhält das Signal, dass mehrere Objekte untereinanderliegen. Letztlich schwächt sich das Signal mit der Zeit ab, da immer mehr Wellen durchtreten. Zu erkennen sind Reverberationen an dem häufig sehr symmetrischen Abstand der gleich aussehenden Linien.
Hinter flüssigkeitsgefüllten Strukturen kommt es durch den ungehinderten Durchtritt des Schalls durch die Flüssigkeit zu einer verstärkten Reflexion an diesem Übergang. Im Rahmen der Regionalanästhesie tritt dieses Phänomen insbesondere bei Blutgefäßen auf.
Bogenartefakt
Anisotropie
Bindegewebe, Muskulatur und Nervenfasern haben häufig eine strenge geometrische Anordnung, da sie eine bestimmte Verlaufsrichtung haben. Wenn Schallwellen im 90°-Winkel auf sie treffen, werden sie im gleichen Winkel reflektiert, und es ist ein besseres Signal darstellbar. Um einen Nerven besser darstellen zu können, ist der Winkel von besonderer Bedeutung. Manchmal ist es nötig, den Schallkopf zu kippen, um den Einfallswinkel der Schallwellen zu verändern, sodass der Nerv besser zu erkennen ist. Das gilt insbesondere für periphere Nerven.
Dorsale Schallauslöschung
Besonders dichte Strukturen, wie zum Beispiel Knochen oder auch Konkremente, führen zu einer kompletten Reflexion der Schallwellen. Dahinter liegende Strukturen können nicht mehr wahrgenommen werden. Dies bezeichnet man als dorsale Schallauslöschung.
Zystenrandschatten:
Zystenrandschatten entstehen randbildend an flüssigkeitsgefüllten Hohlräumen mit dicken Wänden. Der Schall durchquert hierbei tangential die Wand über eine längere Strecke und wird absorbiert, wodurch es zu einer dorsalen Schallauslöschung kommt.
Bildoptimierung
Um die Bildeinstellungen zu vereinfachen, gibt es häufig vordefinierte Untersuchungseinstellungen, je nachdem, ob man gerade einen Nerv, das Herz oder die Bauchorgane darstellen will. Außerdem bieten viele Geräte heutzutage eine automatische Korrektur der Bildeinstellungen (iScan (Philips), CTO (GE) zur Anpassung von Gesamtverstärkung (Gain) und tiefenselektiver Verstärkung (TCG)).
Fokuseinstellung
Die Einstellung des Fokus bietet die Möglichkeit, die Schallwellen in einer bestimmten Distanz zu bündeln und dort eine gezielte Auflösung zu ermöglichen. Der Fokus sollte also immer auf das Ziel eingestellt werden. Hinter der Fokuszone kommt es zur Divergenz der Schallwellen.
Gesamtverstärkung (Gain)
Es kann eine akustische Verstärkung der geschwächten wiederkehrenden Signale erfolgen. Hier ist eine Einstellung zu wählen, die eine gute Sicht der relevanten Strukturen ermöglicht, aber eine zu hohe Verstärkung (weißes Bild) vermeidet.
Tiefenselektive Verstärkung (TCG, time corrected gain)
Hier können in Abhängigkeit der Laufzeit Schallwellen verstärkt werden. Es gibt in der Regel mehrere Schieberegler, anhand welcher man mehrere Bildbereiche unterschiedlich verstärken kann. Der Hintergrund ist der hohe Verlust an Signal in tieferen Gewebeschichten.
Bildfrequenz (frame rate)
Die Bildfrequenz ist von verschiedenen Faktoren abhängig, die nötig sind, um das Bild zu erstellen. Je breiter der dargestellte Sektor ist, desto mehr Scanlinien müssen verarbeitet werden. Je größer die eingestellte Länge der Schallkeule ist, desto länger brauchen auch die Schallwellen, um diese Länge zurückzulegen. Wenn zusätzlich noch ein Dopplersignal ermittelt wird, verzögert das ebenfalls die Bilddarstellung.
Bildoptimierung im Rahmen der Standards der Anlagetechnik
Bei den oben genannten Punkten handelt es sich um die technische Bildoptimierung. Zu den Standards in der unmittelbaren Einstellung der Zielstruktur gilt es, die Eindringtiefe so gering wie möglich zu wählen, um eine möglichst hohe Auflösung zu generieren. Die Zielstruktur sollte bei Out-of-Plane Verfahren mittig liegen, bei In-Plane Verfahren möglichst nadelfern. Sofern möglich, sollten bei mehreren Zielnerven alle im gewählten Schnitt sichtbar sein (axillärer Plexus). Leidet die Qualität der Darstellung darunter, ist ein mehrfaches Einstechen in mehreren Ebenen einem unsicheren Vorgehen immer vorzuziehen. Zur Optimierung des Verfahrens gehört auch ein “stabiles” Bild, was dadurch erreicht werden kann, dass die Hand des Untersuchers aufliegt und das Setting so gewählt wird, dass der Rest der Intervention mit der nicht schallenden Hand durchführbar ist.
Welche Ultraschallsonde?
Die zu verwendende Ultraschallsonde ist abhängig von der durchzuführenden Regionalanästhesie. Alle von uns dargestellten Blöcke können mit dem Linearschallkopf durchgeführt werden. Alternativ eignet sich auch die konvexe Sonde für die Regionalanästhesie. Diese wird unter anderem bei einigen weiterführenden, tieferen Blöcken benötigt, auf die wir hier nicht eingehen.
Der große Vorteil des Linearschallkopfes ist die hohe Frequenz und damit die gute Auflösung. Dafür nimmt man eine geringe Eindringtiefe in Kauf. Da wir jedoch nur oberflächliche Strukturen punktieren, stellt dies kein Problem dar.
Positionierung des Ultraschallgerätes
Das Ultraschallgerät sollte so positioniert werden, dass sowohl die Nadel als auch der Bildschirm ohne viel Bewegung eingesehen werden können. Davon abgesehen sollte man eine möglichst bequeme und rückenschonende Haltung einnehmen. Nachfolgend sind einige Beispiele:
Wann sollte man vor dem Block schallen?
In den meisten Fällen führt es nur zu einer Verzögerung, wenn man vor dem Durchführen einer Regionalanästhesie “probeschallt”. Dennoch gibt es einige Situationen, in denen dies angebracht ist.
Sollte bei einem/ einer Patient:in ein ausgeprägtes Hämatom bestehen, wie es bei Patient:innen unter Antikoagulation und nach einem Trauma häufiger vorkommt, kann es sein, dass Landmarken schwer zu erkennen sind. Das gleiche gilt für Patient:innen, die Flüssigkeit eingelagert haben und sich mit ausgeprägten Ödemen oder Anasarka darstellen.
Wenn erschwerte Anlagebedingungen erwartet werden, beispielsweise bei eingeschränkter Mobilität, sollte auch überprüft werden, ob die Zielstrukturen im Ultraschallbild gesehen werden können.
Bei einigen Blockaden wiederum ist es notwendig, sich vorab einen Überblick zu verschaffen. So kann das Ultraschallgerät sinnvoll eingesetzt werden, um die Punktionshöhe bei einem paravertebralen oder einem Erector spinae Block festzulegen.
Standards der Anlagetechnik
Fächertechnik Out-of-Plane/In-Plane:
Bei der Fächertechnik handelt es sich um ein einfaches Verfahren zur sicheren Visualisierung der Nadel und zur Reduktion des Nebenwirkungs- und Verletzungspotenzials. Nach der erfolgten Bildoptimierung gemäß den oben genannten Vorgaben kann die Tiefe der Zielstruktur am Ultraschallgerät abgelesen werden, und die Nadel wird bei starrem Schallkopf mit Sicht aufs Interventionsfeld durch die Haut in den Situs eingebracht. Als Orientierung für den Abstand von Nadel und Schallkopf kann die Tiefe der Zielstruktur dienen, die jedoch individuell angepasst werden muss. Nach Penetration der Haut wird die Nadel abgeflacht und vorsichtig ins Schallfenster eingebracht. Hierbei sollte penibel darauf geachtet werden, dass die Achsen von Nadel und Schallkopf entweder achsengleich (In-Plane) oder rechtwinklig (Out-of-Plane) zueinander stehen. Bei der Out-of-Plane-Technik sollte die mittige Markierung auf dem Schallkopf als Orientierung genutzt werden. Für die In-Plane-Technik gibt es häufig auch Orientierungspunkte an der Schallsonde.
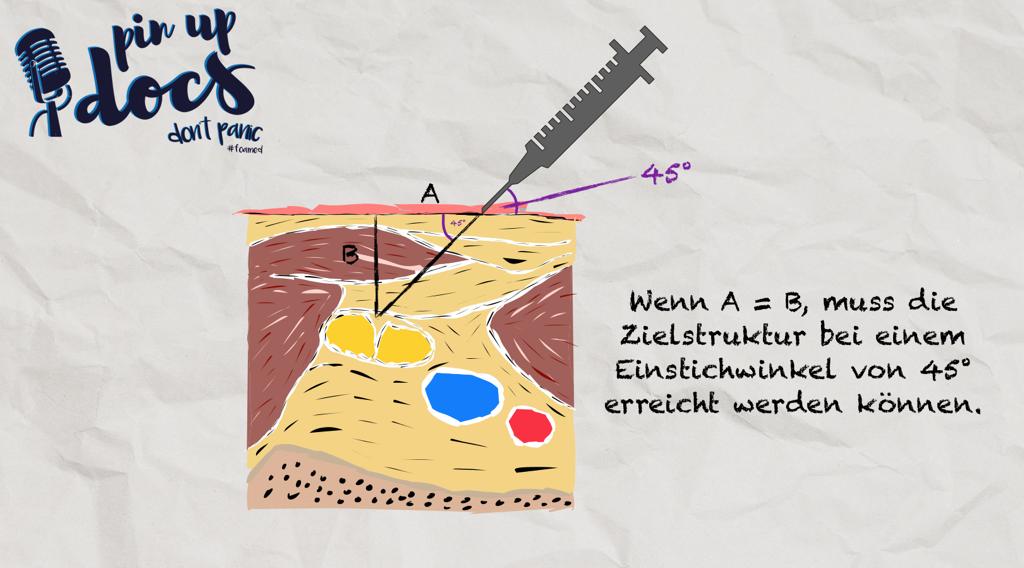
Out-of-Plane:
In der Out-of-Plane-Technik ist die Nadel als heller, reflektierender Punkt zu sehen. Sobald dieser im Bild erscheint, handelt es sich folglich um die Nadelspitze. Ist diese sicher oberflächlich und mittig im Schallfenster identifiziert, sollte erneut überprüft werden, ob die Zielstruktur weiterhin mittig unter der Sonde liegt. Ist dies der Fall, wird die Nadel ein Stück zurückgezogen und der Einstichwinkel etwas steiler gewählt, bevor der erneute Vorschub erfolgt und die Nadelspitze wieder visualisiert wird. Entspricht der Abstand von Einstichstelle zu Schallkopf exakt dem Abstand von Schallkopf und Zielstruktur, so sollte der endgültige Vorschubwinkel 45° zur Haut betragen.
Walk-Down-Technik:
Diese Technik gilt auf Grund der peniblen Darstellung der Nadelspitze als sicherste Methode und als Goldstandard unter den Anlagetechniken. Die Zielstruktur wird gesichtet, danach wird der Schallkopf zur geplanten Einstichstelle bewegt. Die Nadelführung erfolgt Out-of-Plane. Sobald der Reflex der Nadelspitze zu sehen ist, wird die Bewegung der Nadel unterbrochen und der Schallkopf wird weiter in Richtung Zielstruktur bewegt oder gekippt. Dies wird solange wiederholt, bis die Zielstruktur erreicht wird.
In-Plane:
Ist die Nadelspitze sicher oberflächlich und mittig im Schallfenster identifiziert, sollte erneut überprüft werden, ob die Zielstruktur weiterhin im nadelfernen Schallfenster liegt. Ist dies der Fall, wird die Nadel ein Stück zurückgezogen und der Einstichwinkel wird steiler gewählt, sodass die verlängerte Achse der Nadel genau auf die Zielstruktur zeigt, bevor der erneute Vorschub erfolgt. Bei der In-Plane-Technik ist es obligat, dass die Nadel im Schallfenster achsengerecht vorgeschoben wird, damit die Spitze sicher identifiziert werden kann.
Nach diesem Vorgehen nähert man sich langsam der Zielstruktur, ohne Gefahr zu laufen, sich bei einem primär geschätzten Einstichwinkel zu vertun und somit eine Komplikation zu provozieren. Häufig befinden sich andere vulnerable Strukturen in direkter Nähe zu unseren Zielstrukturen. Dieses Fächern von oberflächlich nach tief sollte umso kleinschrittiger erfolgen, je unerfahrener der Anwender/ die Anwenderin ist.
Aspirationsmanöver und standardisierte Ansagen
Wie bei so ziemlich allem in der Medizin ist der Erfolg einer Intervention von den durchführenden Personen und deren Zusammenarbeit abhängig. Und wie bei so ziemlich jeder Teamleistung mit wechselnden Partner:innen bringen Standards Sicherheit.
Während der Anlage einer Regionalanästhesie ist der Blick der durchführenden Person nach Penetration der Haut und Visualisierung der Nadelspitze auf dem Ultraschallmonitor fixiert. Das Aspirationsmanöver und die Infiltration des Lokalanästhetkums werden durch die Pflegekraft nach standardisierten Ansagen durchgeführt.
Kommando 1 „Aspiration“: Hierauf aspiriert die Pflegekraft über die mittels Perfusorleitung an der Nadel befestigte Spritze. Der Blick der Pflegekraft ist dabei auf den nadelnahen Teil der Perfusorleitung gerichtet, um eine Blut- oder Luftaspiration sofort detektieren zu können.
Kommando 2 „Aspiration negativ“: Hiermit bestätigt die Pflegekraft der durchführenden Person, dass kein Blut oder Luft in der Perfusorleitung detektiert wurde und die Infiltration somit sicher ist. Sollte dies nicht der Fall sein, so ist die durchführende Person darüber in Kenntnis zu setzen und nach den Angaben im Teil „Was machen bei Komplikationen?“ vorzugehen.
Kommando 3 „……ml applizieren“: Nach bestätigter negativer Aspiration sagt die durchführende Person der Pflegekraft die Menge an Lokalanästhetika, die appliziert werden soll, an.
Kommando 4 „……ml appliziert“: Nach Applikation der gewünschten Menge bestätigt die Pflegekraft die vollständige Applikation. Die durchführende Person beobachtet dabei die sonographische Verteilung des Lokalanästhetikums. Verteilt sich das Lokalanästhetikum nicht im erwarteten Bereich, so ist die Applikation abzubrechen und die Lage der Nadelspitze zu korrigieren. Fällt der Pflegekraft während der Applikation ein erhöhter Widerstand auf, sollte die Applikation unterbrochen und die Position der Nadelspitze korrigiert werden. Bei größeren Mengen des Lokalanästhetikums (z. B. bei Flächenblockaden) erfolgt in unserer Klinik eine Zwischenaspiration, um eine akzidentelle Lageveränderung der Nadel und damit einhergehende intravasale Lage nicht zu übersehen. Die Zwischenaspirationen werden durch die Pflegekräfte eigenständig durchgeführt. Bei einer neuen Etablierung dieser Verfahren sollte ein Standard an Millilitern festgelegt werden, nach der eine Zwischenaspiration durchzuführen ist.
Kommando 5 „……ml übrig“: Nach jeder Applikation, ob vollständig oder abgebrochen, gibt die Pflegekraft der durchführenden Person eine Rückmeldung über den Füllungsstand der Spritze, sodass die durchführende Person weiß, wie viel Lokalanästhetika bereits insgesamt verabreicht wurden.
Katheteranlage
Wenn ein Schmerzkatheter gelegt wird, erfolgt dies vom Prinzip ähnlich wie bei der Single-Shot Anästhesie. Da jedoch eine größere Nadel genutzt wird, erfolgt erst eine Lokalanästhesie. Anschließend wird die Einführnadel (bei uns eine Tuohy-Nadel) unter Ultraschallkontrolle zum Zielgebiet vorgeführt. Nach den oben beschriebenen Kommandos wird etwas Lokalanästhetikum gespritzt. So bildet sich durch die Hydrodissektion ein Raum, in den der Katheter eingeführt werden kann.
Durch die Einführnadel kann der Katheter so weit wie möglich vorgeschoben werden. Anschließend schaut man auf die Zentimeterskala auf der Einführnadel, um die Einstichtiefe zu ermitteln. Die Einführnadel wird herausgezogen und der Schmerzkatheter anhand der Markierungen so weit zurückgezogen, dass er mit einer Mindestlänge, die die Eindringtiefe der Einführnadel und eine Sicherheitsreserve von drei Zentimetern umfasst, in situ liegt.
Zur Lagekontrolle des Katheters wird das Zielgebiet erneut mit dem Ultraschall dargestellt. Es wird versucht, die Spitze des Katheters darzustellen und die Injektion sichtbar zu machen. Hierzu empfiehlt es sich, einen Farbdoppler einzusetzen. Unter vorsichtigem pulsatilen Druck auf den Stempel kann an der Katheterspitze ein Farbjet erzeugt werden.
Anschließend kann der Katheter angenäht oder befestigt werden.
Welche Adjuvantien?
Es gibt verschiedene Adjuvantien, welche die Wirkung der Regionalanästhesie beeinflussen sollen. Sie können den Wirkeintritt beschleunigen und die Wirkdauer verlängern. Bei einem Einsatz der meisten Adjuvantien handelt es sich um einen off-lable use. Bei Interesse kann in einer open access Metaanalyse nach Desai et al. aus 2021 näheres über verschiedene Adjuvantien nachgelesen werden. Außerdem verweisen wir auf einen eigenen Beitrag zu diesem Thema in der Dezemberfolge 2022 des Podcasts. [16]
Der Übersichtlichkeit halber gehen wir nur auf Dexamethason ein, welches auch in unserer täglichen Praxis systemisch, also nicht als Beimischung zum LA, eingesetzt wird. Dies ist im Übrigen auch die Empfehlung aus dem oben verlinkten Artikel. Bei perineuraler Applikation verlängert Dexamethason sowohl die Analgesie als auch die sensorische und motorische Blockade um gut vier Stunden. Hinzu kommt, dass der postoperative Opiatverbrauch um ein Äquivalent von 19 mg Morphin reduziert wurde. Dies wird erkauft durch die unerwünschte Erhöhung des Blutzuckerspiegels um 4 mg/dl (0,2 mmol/L). In Vergleichsstudien, wie der von MacHardy et al. aus 2020, konnte gezeigt werden, dass die systemische Gabe gleichwertige Wirkungen erzielt. [17]
Es kursieren drei Theorien zur Wirkung von Dexamethason: Die erste thematisiert eine Glukokortikoid-Rezeptor vermittelte Expression inhibitorischer Kaliumkanäle in den wenig myelinisierten C-Fasern, welche die Erregbarkeit derselben herabsetzen. Der zweiten Theorie zufolge kann eine lokale Vasokonstriktion, erzeugt durch das Dexamethason, die Aufnahme und den Abbau der LA vermindern. Die dritte Theorie schreibt den Effekt der systemischen antiinflammatorischen Wirkung nach systemischer Gabe zu. Äquivalent hierzu zeigt Dexamethason keine Verlängerung der Blockade, wenn der inflammatorische Reiz durch die Operation fehlt, s. Marhofer et al. 2019. [18]
Was machen bei Zwischenfällen?
Blutaspiration [19]
Sollte bei einer Aspirationsprobe Blut im Schlauch auftreten:
- Nadel entfernen
- Einstichstelle mehrere Minuten komprimieren
- Schlauch zeitnah durchspülen, um das Blut zu beseitigen
- Erneute Punktion
- Dokumentation
- Erhöhte Wachsamkeit für Symptome einer Lokalanästhetika-Intoxikation
Parästhesie [19, 20]
Spürt der Patient oder die Patientin bei der Punktion einen “Stromschlag”, wurde mit der Nadel ein Nerv berührt.
- Nadel zurückziehen
- Den Patienten/ die Patientin beruhigen
- Erneute Punktion
- Dokumentation
Was machen bei Komplikationen?
1. Melden
Der Verdacht ist, unabhängig wer ihn hegt, zu äußern. Niemand kann zu jedem Zeitpunkt Monitor, Patient:in, Spritze und Ultraschallbildschirm im Blick behalten, jedes Teammitglied sollte seiner Verpflichtung nachkommen, bei dem Verdacht einer Komplikation dieses dem Verantwortlichen (in diesem Falle dem durchführenden Anästhesisten/ der durchführenden Anästhesistin) mitzuteilen.
2. Sichten
Nach der Äußerung des Verdachts auf eine Komplikation liegt es in der Verantwortung der/des durchführenden Ärztin/Arztes alle zur Verfügung stehenden Informationen zu sichten. Patientenstatus erheben: Neu aufgetretenes neurologisches Defizit? Horner-Syndrom? Kreislaufdysregulation? Herzrhythmusstörungen? Respiratorische Verschlechterung?
3. Reagieren
Erhärtet sich der Verdacht einer Komplikation, so muss darauf eine Reaktion folgen. Im Vordergrund steht das Beenden bzw. Pausieren der Intervention, die symptomatische Therapie, das Hinzuziehen von Hilfe/Expertise und gegebenenfalls das Behandeln der Komplikation im Speziellen.
4. Dokumentieren
In jedem Fall sollte bei einem erhärteten Verdacht oder bei einer bestätigten Komplikation eine detaillierte Dokumentation erfolgen (Inhalte siehe folgenden Abschnitt Dokumentation).
Dokumentation
Kommt es zu einer Komplikation muss aus medicolegalen Gründen eine Dokumentation erfolgen. (Das gebietet § 630f., BGB, wonach “sämtliche […] wesentlichen Maßnahmen und Ergebnisse aufzuzeichnen” sind.) Die Dokumentation sollte beinhalten:
- Wobei ist die Komplikation aufgetreten?
- Verfahren
- Medikation
- Wem wurde die Komplikation gemeldet?
- Symptombeginn
- Dynamik der Symptome
- Maßnahmen, die ergriffen wurden
- Re-Evaluation
- Sich aus der Komplikation ergebende Anordnungen für die Station
Fragliche intravasale Applikation
Ergibt sich entweder durch Symptome, wie zum Beispiel Prodromi einer Lokalanästhetika-Intoxikation (LAST) oder durch den Ablauf der Regionalanästhesie, der Verdacht auf eine intravasale Gabe von Lokalanästhetika, sollte ebenfalls nach den Punkten im allgemeinen Teil vorgegangen werden:
- Eine Erweiterung des Monitorings sollte überlegt werden
- Man muss sich auf eine LAST vorbereiten
- Notfallwagen holen
- Lipid-Rescue vorbereiten
- Atemwegsmanagement vorbereiten
- Reanimationsbereitschaft herstellen
- Dokumentation
Lokalanästhetika-Intoxikation (LAST)
Die Lokalanästhetika-Intoxikation (local anaesthetic systemic toxicity, LAST) ist sowohl bei peripheren als auch periduralen Blockaden ein seltenes Ereignis mit einer Inzidenz von 0,004 – 0,18 %.
Die Natriumkanalblockade durch LA erfolgt nicht nur an peripheren Nervenzellen. Wird ein LA in größeren Mengen systemisch aufgenommen, kann es auch zu systemischen Wirkungen kommen. Die wichtigsten Nebenwirkungen treten am Herzen und im Gehirn auf. Generalisierte Krampfanfälle und Herz-Kreislauf-Stillstand sind die maximalen Ausprägungen der LA-Intoxikation.
Die ersten prodromalen Zeichen, die von Patient:innen beschrieben werden, entstehen durch die Hemmung inhibitorischer Nerven, welche näher an der Blut-Hirn-Schranke liegen als andere Nerven. Die Symptome reichen von Schwindel, Ohrgeräuschen und Tinnitus bis zum oft beschriebenen metallischen Geschmack im Mund. Im nächsten Schritt kann es zu Kloni der Muskulatur, Tremor oder Shivering kommen. Hierauf folgt als nächste Stufe der generalisierte Krampfanfall und nach weiterer Diffusion eine Blockade exzitatorischer Nerven mit Atem- und Kreislaufdysregulation. Bei Krampfanfällen sollten wie gewohnt Benzodiazepine eingesetzt werden. Im Rahmen von Bewusstlosigkeit und Atemstörungen ist eine ausreichende Oxygenierung auch durch ein Atemwegsmanagement zu gewährleisten. Treten nur leichte neurologische Symptome auf, ist zu erwägen, die geplante Operation nach Abklingen der Symptome durchzuführen. Diese Entscheidung sollte jedoch im gesamten Team besprochen werden.
Kardiale Nebenwirkungen entstehen sowohl über die Hemmung inhibitorischer Neurone und einen konsekutiv gesteigerten Sympathikotonus als auch über eine direkte myokardiale Depression und negative Inotropie. Letztere tritt erst bei höheren systemischen Dosen auf. Des Weiteren können verschiedene Formen von Herzrhythmus- und Reizleitungsstörungen auftreten. Eine Vasodilatation durch direkte Wirkung auf die Gefäßmuskulatur wird ebenfalls angenommen. Sollte ein Herz-Kreislauf-Stillstand eintreten, wird gemäß den aktuellen ERC-Leitlinien reanimiert. Adrenalin steht hier aufgrund seiner proarrhythmogenen Eigenschaften im Mittelpunkt der wissenschaftlichen Diskussion. Allerdings gibt es momentan keine verwertbaren klinischen Daten, die gegen eine Adrenalin-Gabe in Reanimationsdosis von 1 mg alle 3-5 Minuten sprechen. Die Reanimation ist tendenziell so lange fortzusetzen, wie die Wirkung des LA andauert (bei Bupivacain > 6h). Stellt sich durch die Reanimationsmaßnahmen nicht zeitnah ein ROSC ein, sollte man über eCPR nachdenken. Hierzu sei erwähnt, dass es nach der Lipidgabe zu Ablagerungen in der ECMO mit darauffolgenden Verstopfungen und Geräteausfällen ebenso wie zur Bildung von Blutgerinnseln kommen kann. Steht eine eCPR zur Verfügung, ist die Indikation von Lipiden kritisch zu überprüfen. [21]
Nicht alle LA sind gleich toxisch. Insbesondere länger wirksame LA, wie Bupivacain oder Ropivacain, haben eine höhere Toxizität als kürzer wirksame, was mit der Lipophilie zusammenhängt. Äußerst lipophile LA stören außerdem die oxidative Phosphorylierung an Kardiomyozyten. Grundsätzlich steigert eine azidotische Stoffwechsellage die Toxizität von LA. [22]
Sollten bei Patient:innen während oder nach einer Regionalanästhesie entsprechende Symptome auftreten, muss die Zufuhr von LA sofort beendet werden. Es kann auch durch die Umverteilung von lipophilen LA zu einer verzögerten Intoxikation kommen, sodass Patient:innen nach einer Regionalanästhesie überwacht werden sollten. [22]
Als Antidot wird 20%-ige Lipidemulsion (LipidRescue) verwendet. Dieses ist an allen Orten, wo Regionalanästhesien durchgeführt werden, vorzuhalten. Es ist strittig, ob die Gabe wirklich hilfreich ist, da es momentan, abgesehen von Fallberichten oder -serien, welche einem möglichen Publikationsbias unterliegen, nur Daten aus Tierversuchen gibt. Natürlich ist aber auch zu erwähnen, dass die Datenerhebung bei einer geringen Inzidenz insgesamt eher schwierig ist. Es gibt verschiedene Theorien, deren kombinierter Wirkung man den Effekt zuschreibt. Nach der „Shuttle“-Theorie (auch „Scavenging“-Effekt) kommt es durch Lipidtröpfchen zu einem Herauslösen von LA aus gut durchbluteten Organen, wie Herz und Hirn, und einer Umverteilung in die Peripherie. Dies erleichtert durch die Mobilisation auch den Abbau in der Leber. Ein bisher ungeklärter Effekt der Lipidemulsion verbessert den Gefäßtonus und das Herzzeitvolumen. Er wird als kardiotonischer Effekt bezeichnet. Und letztlich kommt es durch die Lipide zur Aktivierung kardioprotektiver Signalkaskaden in den Herzmuskelzellen. Die vielen bekannte „Lipid-Sink“-Theorie ist mittlerweile veraltet. Man nahm an, dass sich durch den erhöhten Lipidanteil Mizellen im Blut bildeten, die das LA dort binden. Sie wurde nach neueren Erkenntnissen zur “Shuttle”-Theorie erweitert. Generell lässt sich noch ergänzen, dass die „Lipid-Rescue“-Therapie besser wirkt, je lipophiler das ursächliche LA ist. [22]
Die Lipidemulsion wird bei Erwachsenen als Bolus von 100 ml (1,5 ml/kg KG bei < 70 kg) gegeben. Tritt innerhalb der ersten fünf Minuten keine Besserung ein, kann der Bolus wiederholt werden. Nach der Gabe der Initialboli sollte eine Dauerinfusion von 200-250 ml über 15-20 Minuten verabreicht werden (0,25 ml/kg KG/min bei < 70 kg). Auch nach anfänglicher Stabilisierung sollte die Dauerinfusion noch einige Minuten weitergegeben werden. [22]
CAVE: Der Lipidanteil von Propofol reicht nicht zur Therapie aus und das Medikament hat eine negativ-inotrope Wirkung! (Näheres dazu in der S1-Leitlinie Prävention und Therapie der systemischen Lokalanästhetikaintoxikation). [22]
Akzidentelle Anästhesie des Ganglion stellatum
Bei Regionalanästhesien im Halsbereich kann es durch die Umverteilung, insbesondere bei Applikation größerer Mengen Lokalanästhetikums, zu einer versehentlichen Anästhesie des Ganglion stellatum kommen. In der Folge entsteht durch die Betäubung der sympathischen Nervenfasern ein sogenanntes. Horner-Syndrom mit einer typischen Trias aus Ptosis, Miosis und Pseudo-Enophthalmus. Je nach Quelle wird auch eine Anhidrosis im Gesicht oder am Arm noch zu diesem Syndrom gezählt. [23]
Letztlich geht von diesem Syndrom keine akute Gefahr aus. Das Syndrom muss dokumentiert und die Symptomausprägung überprüft werden; und auch die Dokumentation des Zurückbildens der Symptome darf nicht ausbleiben.
Akzidentelle Anästhesie des Nervus phrenicus
Wie bei der versehentlichen Betäubung des Ganglion stellatum ist es bei Regionalanästhesien am Hals auch möglich akzidentiell eine Anästhesie des N. phrenicus hervorzurufen. Hier wiederum kann sich – je nach Konstitution des Patienten und seinen Vorerkrankungen – eine klinisch relevante Problematik entwickeln. Die Folge der Betäubung des N. phrenicus ist ein Zwerchfellhochstand auf der ipsilateralen Seite. Dies kann bereits zu Atemproblemen bei wachen Patient:innen führen. Junge und gesunde Patient:innen bemerken diese Komplikation möglicherweise nicht zwingend, da ein gesunder Lungenflügel für die Oxygenierung ausreicht. Bei älteren, vorerkrankten Personen kann hier aber eine ausgeprägte Oxygenierungsstörung entstehen. [24]
Bei Atemnot in Folge einer Regionalanästhesie muss zwingend an einen Pneumothorax gedacht werden, der am besten unmittelbar durch eine Sonographie ausgeschlossen werden muss.
Es ist anhand des Schemas im allgemeinen Teil vorzugehen. Als Akutmaßnahmen können neben Sauerstoffgabe auch nicht-invasive Beatmung oder sogar eine Intubation notwendig werden. Je nach Ausprägung der Symptomatik ist zu überprüfen, ob die Operation wie geplant stattfinden kann, ob eine Verschiebung der Operation möglich ist oder ob das Anästhesieverfahren angepasst werden muss.
Postoperativ ist eine Überwachung zu gewährleisten, bis sich die Atemnot bessert.
Es gibt einen Fallbericht, in dem die Wirkung der Regionalanästhesie durch eine erneute Punktion des intraskalenären Plexus brachialis und ein “Durchspühlen” mit NaCl aufgehoben werden konnte. Da es hierzu keine Evidenz gibt, kann diese Maßnahme entsprechend nur anekdotisch erzählt und nicht empfohlen werden. [25]
Fragliche Verletzung der Pleura
Sollte es im Rahmen der Anlage einer Regionalanästhesie oder danach zu einer respiratorischen Verschlechterung, zu einer Aspiration von Luft kommen, oder besteht aus einem anderen Grund der Verdacht, dass es zu einer akzidentellen Verletzung der Lunge/Pleura gekommen sein könnte, sollten die im allgemeinen Teil (Was machen bei Komplikationen?) aufgelisteten Punkte abgearbeitet werden. [26]
Wann immer der Verdacht besteht, es liege eine Pleuraverletzung vor, hat ein sonographischer Ausschluss eines Pneumothoraxes zu erfolgen. Dieses Verfahren ist einfach, schnell durchzuführen, äußerst sensitiv und wegen der vorbestehenden „Anwesenheit“ eines Ultraschallgerätes immer verfügbar, sodass zeitnah und ohne weitere Invasivität klare Verhältnisse geschaffen werden können. Besteht der Verdacht weiterhin, sollte die Untersuchung im Verlauf wiederholt oder andere bildgebende Verfahren zur Informationsgewinnung veranlasst werden.
Bestätigt sich der Verdacht, muss umgehend eine symptomatische Therapie eingeleitet und die Anlage einer Thoraxdrainage in Erwägung gezogen werden. Des Weiteren sollte erneut die Dringlichkeit der geplanten Operation auch im Hinblick auf den veränderten Patientenzustand beurteilt werden. Das Anästhesieverfahren ist erneut zu überdenken. (Reicht die bereits durchgeführte Regionalanästhesie für den Eingriff aus oder ist eine zusätzliche Allgemeinanästhesie notwendig? –> CAVE: Erhöhtes Risiko für Spannungspneumothorax). Wird ein erweitertes Monitoring benötigt? Sind postoperative Überwachungskapazitäten vorhanden?
Nervenschäden
Nervenschäden lassen in der Regel nicht akut beurteilen. Durch die Applikation von LA kommt es ohnehin zu einem Ausfall der Nervenfunktion, wodurch der entsprechende Nerv nicht beurteilt werden kann. Treten Parästhesien, wie oben beschrieben, auf, ist dies zu dokumentieren, damit eine Verlaufskontrolle erfolgen kann.
Funktionskontrolle
Während der Durchführung der Regionalanästhesie sind häufig erste Wirkungen zu bemerken: Die Patient:innen beschreiben sehr oft, schon kurz nach der Applikation des LAs, dass sich die betäubte Extremität warm anfühlt und kurz darauf “einschläft”.
Bei der Funktionskontrolle ist zu beachten, dass die Funktionen der Nerven nach der im Bereich Physiologie beschriebenen Einteilung nach Erlanger und Gasser ausfallen. Somit erlöschen als letztes die motorischen Funktionen. Durch eine Bewegung der entsprechenden Kennmuskeln des betäubten Nerven kann also abgeschätzt werden, ob er anästhesiert ist. Dies ist insbesondere bei der axillären Plexusblockade wichtig, weil hierbei viele Nerven betäubt werden. [12]
Was machen bei unvollständiger Blockade?
Die Ausbreitung einer Regionalanästhesie ist abhängig von dem verwendeten LA. Es kann wenige Sekunden bis mehrere Minuten dauern, bis die Wirkung vollständig ausgeprägt ist. Bestehen Zweifel daran, ob das Anästhesieniveau ausreicht, kann man bei Einverständnis des Patienten und ausreichender Zeit auch noch einmal nachspritzen.
Vorgehen beim Team-Time-Out
Bevor der erste Schnitt bei einer Operation durchgeführt wird, erfolgt nach Maßgabe der WHO ein Team-Time-Out. Hierbei sollte die adäquate Analgesie durch den Chirurgen/die Chirurgin überprüft werden, beispielsweise durch Hervorrufen eines Schmerzreizes mit einem chirurgischen Instrument im Operationsgebiet. Bestehen nun noch Zweifel an der Wirkung, kann ergänzend eine sekundäre Allgemeinanästhesie oder zusätzliche intravenöse Analgesie durchgeführt werden.
Nachbetreuung im Aufwachraum
Sollten Patient:innen keine Allgemeinanästhesie oder Sedativa erhalten haben, ist eine zeitnahe oder sogar direkte Verlegung zurück auf die Normalstation möglich. In der Regel braucht es eine gewisse Zeit, bis der Transport organisiert ist, sodass die Patient:innen trotzdem kurzfristig überwacht werden.
Postoperativ ist besonders bei Regionalanästhesien der Extremitäten auf eine gute Lagerung zu achten, da durch die Anästhesie die Gefahr für Lagerungsschäden oder akzidentelle Verletzungen steigt. Auch postoperativ angelegte Verbände oder Schienen sind aus dem gleichen Grund zu überprüfen. Bei einer Mobilisation des Patienten/der Patientin ist darauf zu achten, dass immer noch eine motorische Blockade bestehen kann. Der Patient / die Patientin darf also nicht alleine aufstehen.
Kathetervisite auf Station
Im Rahmen der Schmerzvisite werden die Patient:innen mit Schmerzkathetern auf peripheren Stationen visitiert. Hierbei sollten folgende Punkte beachtet und dokumentiert werden:
- Schmerzstatus des Patienten/ der Patientin (numerische Analogskala, wie viele Bolusgaben waren nötig?)
- Laufrate der Schmerzpumpe mit Medikament und Dosierung
- Weitere intravenöse oder orale Analgetika
- Begutachtung der Einstichstelle auf Entzündungszeichen und Leckage
- Nebenwirkungen wie Parästhesien, Taubheitsgefühl, motorische Einschränkungen und weitere Nebenwirkungen (z. B. Horner-Syndrom)
Spezieller Teil
Disclaimer: Die dargestellten Bilder wurden an jungen und schlanken Kolleg:innen erstellt. Sie weichen daher durchaus von der alltäglichen Praxis ab, demonstrieren aber ideal die Sono-Anatomie.
Obere Extremität
Oberflächlicher Plexus cervicalis Block
Ziel-Nerv:
- Oberflächliche sensorische Anteile der Nervenwurzeln C2 bis C4, welche als Endäste die Nerven N. occipitalis minor, N. auricularis magnus, N. transversus colli und Nn. supraclaviculares bilden
Blockart:
- Nervenblock/Flächenblock
Indikationen:
- Endarteriektomie der A. carotis bei wachen Patient:innen (ermöglicht direktes verbales oder motorisches Feedback und senkt die Notwendigkeit einer vorübergehenden Shuntanlage)
- Entnahme von Lymphknoten
- Oberflächliche Operationen im Halsbereich
Spezielle Kontraindikationen:
- Kontralaterale Stimmbandparese
Allgemeines:
Der Plexus cervicalis entsteht aus den ersten Spinalnerven, die aus den Foramina intervertebrales der Wirbelsäule hervortreten. Die einzelnen Fasern verzweigen sich zu den Nerven, welche den Hals sensorisch innervieren. Von den motorischen Wurzeln werden diverse Halsmuskeln versorgt. Dadurch, dass die sensorischen Endäste alle am selben Punkt durch die Muskeln treten, können sie sehr einfach betäubt werden.
Anatomie:
Die sensiblen Nerven des Plexus cervicalis treten mittig am Hals hinter dem M. sternocleidomastoideus (Punctum nervosum oder Erb-Punkt) als N. occipitalis minor, N. auricularis magnus, N. transversus colli und Nn. supraclaviculares heraus und versorgen sensibel den Halsbereich. Die Nerven werden durch die Fascia praevertebralis von den Scalenusmuskeln und dem Plexus brachialis getrennt, sodass eine versehentliche Anästhesie bei intakter Faszie vermieden wird.
Der motorische Anteil der Spinalnerven C2 bis C4 versorgt insbesondere die paravertebrale Halsmuskulatur, die Scalenusmuskeln, aber auch das Diaphragma, Teile des M. trapezius und des M. sternocleidomastoideus. Eine motorische Blockade ist aber nur bei tiefer Anästhesie des Plexus cervicalis zu erzielen.
Sonoanatomie:
Die Nerven des Plexus cervicalis sind teilweise als kleine wabenförmige Strukturen im Bereich unterhalb des M. sternocleidomastoideus zu sehen. Wenn sie nicht zu visualisieren sind, kann dennoch ein Flächenblock durchgeführt werden. Unterhalb dieses Kompartiments schließt sich der M. levator scapulae an, welcher durch die Fascia praevertebralis abgegrenzt wird. Medial dieses Muskels, ebenfalls unterhalb der Faszie, treten die Spinalnerven des Plexus brachialis auf Höhe der entsprechenden Halswirbel heraus. Im Ultraschall lässt sich der Sulcus nervi spinalis mit seinem Tuberculum anterius und posterius und davor der entsprechende Spinalnerv darstellen.
Die hier dargestellten Bilder sind ca. in Höhe C3/C4 aufgenommen worden. Je tiefer man mit dem Schallkopf kommt, desto weiter wandern die Nerven nach lateral und können dann ebenfalls anästhesiert werden.
- Grüner Kreis: Nerven des Plexus cervicalis
- Entlang der Fascia praevertebralis, oberhalb der grünen Linie, wird infiltriert
- AC: A. carotis interna
- VJI: V. jugularis interna
- SCM: M. sternocleidomastoideus
- LS: M. levator scapulae
- PT: Processus transversus
Mögliche Komplikationen:
- Heiserkeit
- Dysphagie
- Anästhesie des Plexus brachialis
- Anästhesie des Ganglion stellatum
- Anästhesie des N. phrenicus (nur wenn die Fascia praevertebralis durchstochen wird)
- Anästhesie des N. laryngeus recurrens mit Stimmbandparese
Durchführung:
Es erfolgt eine Punktion in der In-Plane-Technik von dorsal aus. Die Nadel wird, unter direkter Sicht der Spitze, unter den M. sternocleidomastoideus in die Fascia praevertebralis vorgeschoben. Hier werden ca. 10-15 ml des Lokalanästhetikums injiziert. Sollte der Block für eine Operation an der A. carotis gestochen werden, empfiehlt es sich, entlang der geplanten Schnittführung und am Mastoid eine lokale Infiltration durchzuführen. Dies sorgt für weniger Reize durch etwaige Haken. Es ist ebenfalls darauf zu achten, dass die Carotisscheide nicht immer ausreichend analgesiert ist und eine zusätzliche Infiltration durch den Operateur notwendig werden kann.
Vorteile:
- Operation der A. carotis an wachen Patient:innen möglich
Nachteile:
- Sehr viele Leitungsbahnen in unmittelbarer Nähe
- Wenig Raum, daher gilt es größere Mengen Lokalanästhetikum zu vermieden
- Ggf. ist noch eine Anästhesie der Gefäßnervenscheide und cutane/subcutane Infiltrationen sowie eine Infiltration am Kieferwinkel durch den Chirurgen/ die Chirurgin notwendig, um die Operation gänzlich schmerzfrei durchführen zu können.
Alternativen:
- Allgemeinanästhesie
- Kombiniertes Verfahren aus Regional- und Allgemeinanästhesie
Anatomie des Plexus brachialis
Die meisten von uns bekommen bei der Erwähnung dieses Nervengeflechts Flashbacks vom Anatomiesemester. Nichtsdestotrotz muss man sich bei Regionalanästhesien der oberen Extremität wohl oder übel noch einmal mit dem Aufbau auseinandersetzen.
Der Plexus brachialis setzt sich aus den vorderen Rami der Spinalnerven C5 bis Th1 zusammen. Oberhalb des Schlüsselbeins gliedert sich der Plexus im s. g. Pars supraclavicularis in den Truncus superior (C5 und 6), medius (C7) und inferior (C8 und Th1). Zusätzlich ziehen auch noch einzelne direkte Fasern aus dem Plexus. Hierzu zählen der N. dorsalis scapulae (C3-C6), N. subclavius (C5-C6), N. suprascapularis (C4-C6) und der N. thoracicus longus (C5-C7).
Ausgehend von den Trunci verflechten sich die Nerven zu sechs Divisiones: jeweils drei anteriore und posteriore.
Unterhalb des Schlüsselbeins, im Pars infraclavicularis, verflechten sich die Primärstränge zum Fasciculus lateralis, medialis und posterior. Die Orientierung der Lagebezeichnung erfolgt dabei anhand der A. axillaris. Letztlich laufen die Fasciculi als Endäste des Plexus aus. Aus dem Fasciculus lateralis entstehen der N. musculocutaneus (C5-C7), N. medianus lateraler Teil (C6-C7), N. pectoralis lateralis (C5-C7). Der Fasciculus medialis läuft im N. pectoralis medialis (C8-Th1), N. medianus medialer Anteil (C8-Th1), N. ulnaris (C8-Th1), N. cutaneus brachii medialis (C8-Th1) und dem N. cutaneus antebrachii medialis (C8-Th1) aus. Zu guter Letzt entspringen der N. axillaris (C5-C6), der N. radialis (C5-Th1), die Nn. subscapulares (C5-C7) und der N. thoracodorsalis (C6-C8) aus dem Fasciculus posterior. Der N. medianus entsteht, nachdem sich der laterale und der mediale Anteil durch die Medianusschlinge vor der A. axillaris vereinigen.
Anhand der Aufteilung der Nervengeflechte erschließt sich, dass der Plexus brachialis an verschiedenen Stellen anästhesiert werden kann, angefangen von den Trunci im Bereich der Scalenuslücke, über die Divisiones im Bereich ober- und unterhalb des Schlüsselbeins bis hin zu den einzelnen Ausläufern in der Axilla.
Abbildung des Plexus brachialis
Interscalenäre Blockade des Plexus Brachialis (ISB)
Ziel-Nerv:
- Interscalenärer Plexus (Proximaler Plexus brachialis ohne C8 und Th1 Fasern)
- N. subclavius
- N. suprascapularis
- N. thoracicus longus
- N. dorsalis scapulae
Blockart:
- Nervenblockade
Indikationen:
Operationen/ Analgesie für Eingriffe/ Schmerzen an Schulter, laterale Clavicula, Oberarm und Ellenbogen
- Claviculafraktur mediales oder laterales Drittel (immer kombiniertes Verfahren)
- Humeruskopffraktur
- Arthroskopie
- Schulterluxation
Spezielle Kontraindikationen:
- Bestehende kontralaterale Phrenicusparese
- Bei respiratorisch stark eingeschränkten Patienten genaue Indikationsstellung
- Katheterverfahren nur außerhalb des OP-Feldes
Allgemeines:
Technisch relativ anspruchsvolles Verfahren, vor allem als Katheterverfahren.
Anatomie:
Ziel ist die Infiltration des Plexus ca. auf Höhe C6/7. Als Landmarke kann hierfür der Ringknorpel dienen. Im Regelfall ist es 2-5 cm oberhalb der Clavicula. Die Scalenuslücke liegt topographisch leicht dorsolateral des Musculus sternocleidomastoideus. Der Sternocleidomastoideus ist meistens recht prominent zu erkennen und bei leicht zur kontralateralen Seite gedrehtem Kopf gut als Orientierung zu nutzen.
Sonoanatomie:
Sonographisch sollte der Schallkopf im mittleren Drittel der Clavicula aufgesetzt werden, führt man den Schallkopf nun nach kranial, erscheint im Schallfenster bei Kippen des Schallkopfes nach thorakal die Arteria subclavia, die der Pleura aufliegt. Lateral der Arterie lässt sich der Plexus brachialis in supraclaviculärer Position darstellen. Ist dieser sicher identifiziert, so kann er durch Kippen des Schallkopfes und sanftes Vorrutschen nach kranial bis in die interskalenäre Position verfolgt werden. In der Tiefe zeigt sich meist ein Knochenschatten, der dem Processus transversus C7 entspricht. Medial an der Oberfläche zeigen sich laterale Anteile des Sternocleidomastoideus, darunter gelegen der schmale Musculus scalenus anterior und weiter lateral der meist etwas prominentere Musculus scalenus medius. Die beiden Scalenusmuskeln bilden die Scalenuslücke und werden von einer Faszie bedeckt, die nicht zwingend visualisiert, jedoch bei der Out-of-Plane-Technik zwingend durchstochen werden muss. Am Oberrand der Scalenuslücke lassen sich jetzt die Nervenfasern von C5, darunter die meist zweigeteilten Fasern von C6 und in der Tiefe, in Nähe zum Processus transversus, die prominenten C7 Fasern darstellen. Medial der C7 Faser findet man manchmal die Arteria und Vena vertebralis.
CAVE: Es gibt beim interskalenären Plexus brachialis häufig anatomische Variationen. Die Nervenfasern von C5 können durchaus im M. scalenus medius oder außerhalb der Scalenuslücke verlaufen.
- Grünes Rechteck: Plexus brachialis in der vorderen Scalenuslücke, von vorne nach hinten C5, C6 und C7
- ACI: A. carotis interna
- VJ: V. jugularis interna
- SCM: M. sternocleidomastoideus
- SA: M. scalenus anterior
- SM: M. scalenus medius
- ProT: Processus transversus von einem Halswirbelkörper
Mögliche Komplikationen:
- Verteilung des Lokalanästhetikums über die Halsfaszie zum Nervus phrenicus und dessen Parese mit Zwerchfellhochstand, insbesondere bei größeren Volumina und Blockaden von medial
- Verteilung des Lokalanästhetikums über die Halsfaszie zum sympathischen Grenzstrang und Ganglion stellatum mit Hornersyndrom, hauptsächlich bei größeren Volumina und Blockaden von medial
- Pneumothorax
- Verletzung von großen Halsgefäßen
- Anatomische Variante mit zweigeteiltem C6, wobei ein Teil dorsal oder lateral des M. scalenus medius verläuft
Durchführung:
Sonographie nach dem oben genannten Schema. Den Plexus immer von supraclaviculär nach interscalenär schallen, um Verwechslungen zu vermeiden. Im Hals befinden sich viele im Sono ähnlich erscheinende Strukturen, sodass ein standardisiertes und an der Anatomie orientiertes Vorgehen obligat ist.
Nach Identifikation der Scalenuslücke und der Fasern von C5 und C6 (C7 ist nicht zwingend zu visualisieren) werden die Nervenfasern mittig eingestellt, sodass die Markierung am Schallkopf an der lateralen Seite des Plexus liegt. Nun erfolgt die Nadelpenetration der Haut ca. einen Zentimeter oberhalb der Markierung. Der Nadelvorschub wird nach Standardvorgehen durchgeführt, bis die Nadelspitze am lateralen Oberrand des Plexus zu sehen ist. Anschließend wird die Nadel abgeflacht und die Penetration der Halsfaszie erfolgt unter Sicht. In den meisten Fällen ist das Durchstechen deutlich zu spüren. Nach der Penetration erfolgt eine Probeinfiltration. Ist die Lage der Nadelspitze durch die Infiltration bestätigt, kann die Single-Shot-Blockade beginnen bzw. die Kathetereinlage erfolgen. Ein weiterer Vorschub der Nadel ist nicht notwendig, da sich das Lokalanästhetikum innerhalb der Scalenuslücke um die Fasern verteilt. Lokalanästhetikamengen über 15 Milliliter sind wegen möglicher Umverteilung und Nebenwirkungen zu vermeiden.
Vorteile:
- Infolge der proximalen Blockade sind die Nerven N. subclavius, N. suprascapularis, N. thoracicus longus und N. dorsalis scapulae mit blockiert, was Operationen an der Schulter möglich macht, aber auch die Reposition einer Schulterluxation erleichtert
Nachteile:
- Sonographisch häufig erschwert. Komplikationen sind bei ungeübten Anwendern/Anwenderinnen häufiger
- Katheter kann im OP-Feld sein
Alternativen:
- Supraclaviculärer Plexus
Supraclaviculäre Blockade des Plexus Brachialis
Ziel-Nerv:
- Plexus Brachialis mit Fasern von C5 bis Th1
- Zum Teil werden die Nerven des Pars supraclavicularis ebenfalls mit betäubt
Blockart:
- Nervenblockade
Indikationen:
- Operationen an der oberen Extremität, insbesondere im Bereich des Ellenbogens
- Ellenbogenluxation
Bei Operationen an der Schulter ist der interskalenäre, bei Operationen an der Hand der axilläre Plexus zu bevorzugen.
Spezielle Kontraindikationen:
- Außer den allgemeinen Kontraindikationen existieren keine speziellen
Allgemeines:
Technisch einfaches Verfahren jedoch in unmittelbarer Nähe von Pleura und großen Gefäßen, weshalb eine sichere Technik und Compliance des Patienten/ der Patientin obligat ist. Der Übergang vom ISB zum supraclaviculären Block ist fließend.
Anatomie:
Als Landmarke dient das mittlere Drittel der Clavicula.
Sonoanatomie:
Sonographisch sollte der Schallkopf im mittleren Drittel der Clavicula aufgesetzt werden. Gleitet man nun mit der Sonde nach kranial, erscheint im Schallfenster bei Kippen des Schallkopfes nach thorakal die Arteria subclavia, die der Pleura aufliegt. Lateral davon lässt sich der Plexus brachialis in supraclaviculärer Position darstellen. Der Plexus ist an dieser Stelle von einem Perineurium überzogen und stellt sich als großes Nervenbündel dar. Lateral des Plexus kann der Verlauf des M. scalenus medius zu sehen sein. Ziel ist es, das Schallfenster so einzustellen, dass die Arteria subclavia im medialen Drittel des Schallfensters zu erkennen ist. Mittig im Schallfenster sollte der Plexus visualisiert werden. Nun können durch vorsichtiges Kippen des Schallkopfes die Strukturen der ersten Rippe aufliegend eingestellt werden, womit sich die Wahrscheinlichkeit einer versehentlichen Pleuraverletzung durch zu tiefes Eindringen reduzieren lässt.
- Grüner Kreis: Plexus brachialis
- SCA: A. subclavia
- Rippe: 1 Rippe als “Stichschutz”, um die Pleura nicht zu durchstechen
Mögliche Komplikationen:
- Verletzung der Pleura
- Verletzung von großen schlecht komprimierbaren Gefäßen
Durchführung:
Sobald das Schallfenster optimiert ist, erfolgt der In-Plane Nadelvorschub nach Standard. Bei penibler Nadel-Visualisierung wird das Perineurium am lateralen Oberrand des Plexus penetriert. Die Nadel sollte bis zum unteren Teil des Plexus, der s. g. Corner-Pocket, vorgeschoben werden, um eine Anästhesie des Truncus medius und inferior sicher zu gewährleisten. Nach Testinfiltration und deutlicher Hydrodissektion kann der Bolus appliziert werden. Ein Katheterverfahren ist ebenfalls möglich.
Vorteile:
- Großes, meist gut sonographisch darstellbares Nervenbündel
- Teilweise werden die Nerven des Pars supraclavicularis mit betäubt, ohne die Gefahr einer Phrenicusparese
Nachteile:
- Direkte Lagebeziehung zur Pleura
- Verfahren kann durch Pulsationsbewegungen der Arterie und Atembewegungen erschwert sein
Alternativen:
- Interscalenärer Plexus bei Schulteroperationen
- Axillärer Plexus bei Operationen an Hand und Unterarm
Axilläre Blockade des Plexus brachialis (AXP)
Ziel-Nerv:
- Plexus brachialis mit den 7 Nerven des Pars infraclavicularis:
- N. axillaris
- N. medianus
- N. radialis
- N. ulnaris
- N. musculocutaneus
- N. cutaneus antebrachii medialis
- N. cutaneus brachii medialis
Blockart:
- Nervenblockade
Indikationen:
- Operationen an der oberen Extremität, vornehmlich distal des Ellenbogens
Spezielle Kontraindikationen:
- Außer den allgemeinen Kontraindikationen existieren keine speziellen
Allgemeines:
Häufigster Plexus unserer Klinik (Bremerhaven). Extrem gut geeignet, um Unterarmfrakturen und handchirurgische Eingriffe ohne Allgemeinanästhesie durchzuführen, und zwar bei geringem Komplikationspotenzial und technisch einfacher Durchführung. Eine sedierungsfreie Toleranz einer Oberarmblutsperre kann nur mit suffizienter, proximaler Plexusinfiltration erfolgen, andernfalls werden die sensiblen Hautäste, die den Bereich des Oberarms innervieren, nicht adäquat blockiert. Ein weiteres Problem können die von thorakal kommenden Hautäste darstellen, welche den medialen Teil des Oberarms versorgen. Hier kann es empfehlenswert sein, eine subcutane Infiltration mit Lokalanästhetikum vorzunehmen.
Anatomie:
Als orientierende Landmarke bietet sich der Übergang von M. deltoideus und M. biceps brachii an der medialen Seite des Oberarms an.
Sonoanatomie:
Der Schallkopf sollte so ausgerichtet sein, dass die Nadel von der Seite der Hand, mit der die Punktion durchgeführt wird, im Bild erscheint. Sonographisch lässt sich der Plexus von proximal nach lateral in verschiedenen Konfigurationen darstellen. Je proximaler das Schallfenster gewählt wird, desto wahrscheinlicher ist es, bei einer suffizienten Blockade alle sieben Nerven des Plexus zu betäuben, da der N. axillaris und der N. cutaneus brachii medialis den Plexus relativ früh verlassen. Zuerst sollte die Arteria axillaris mittig eingestellt und von proximal nach distal verfolgt werden. Die vier Hauptnerven sollten identifiziert und im Verlauf dargestellt werden. Der N. musculocutaneus verläuft sehr variabel, aber meistens zwischen den Muskelköpfen des M. biceps brachii und des M. coracobrachialis, wodurch eine Verlaufsuntersuchung des Nervs gelingen kann. Der N. medianus liegt am kranialen Rand der Arterie und verfolgt diese relativ lange. Der N. ulnaris liegt am kaudalen Rand der Arterie und entfernt sich, umso weiter distal der Plexus geschallt wird, nach kaudal von der Arterie weg. Er wird proximal von den Fasern der cutanen Nerven begleitet, die ihn im Verlauf verlassen. Der N. radialis liegt im proximalen Abschnitt unterhalb (dorsal) des N. ulnaris am dorsokaudalen Rand der Arterie und zieht im Verlauf weiter nach dorsokaudal und um den Humerus herum. Der N. radialis und der N. ulnaris lassen sich auch sehr gut in einem Untersuchungsgang von distal nach proximal identifizieren und verfolgen, ausgehend vom Sulcus ulnaris bzw. Humerusschaft.
Proximal
Distal
- Dargestellt ist die Sonoanatomie des rechten Arms. Die Nadel käme von links ins Bild
- Grüne Sterne und Kreise: Sie markieren ungefähr die Lokalisierung der entsprechenden Nerven
- Mu: N. musculocutaneus
- R: N. radialis
- M: N. medianus
- U: N. ulnaris
- B: M. biceps brachii
- L: M. latissimus dorsi
- H: Humerus
Mögliche Komplikationen:
Verletzung von großen Arterien und Venen. Die Venen sind oft durch den Schallkopfdruck komprimiert und können so leicht akzidentell durchstochen werden.
Durchführung:
Nach sicherer Identifizierung aller Nerven durch eine Verlaufsuntersuchung: möglichst proximale Einstellung des gesamten Plexus mit mittlerer bis leicht nadelfernen Einstellung der Arterie. Als wichtige sonoanatomische Landmarke dient die Aponeurose des M. teres major. In-Plane-Punktion nach Standard. Es empfiehlt sich, die nadelfernen Nerven zuerst anzusteuern, um bei einer versehentlichen leichten Luftinfiltration nicht die Sicht zu verlieren.
Vorteile:
Auch bei schwerstkranken Patient:innen (z. B. terminaler Niereninsuffizienz) können Eingriffe, wie Shuntrevisionen/Anlagen und Ähnliches, ohne Allgemeinanästhesie durchgeführt werden.
Nachteile:
Eine genaue Evaluation der Plexusanästhesie ist notwendig, da einzelne Nervenanteile nicht suffizient betäubt sein können und somit das Gesamtergebnis der Anästhesie gefährden.
Alternativen:
- Supraclaviculärer Plexus
- Handblock
- Rescueblockaden einzelner Nerven
- Oberst-Block bei Eingriffen am Finger
Untere Extremität
Anatomie der Hüfte: Da Regionalanästhesien der unteren Extremität zu einem Großteil mit Hüft-OPs zu tun haben, lohnt es sich, die Anatomie des Hüftgelenks anzusehen. Grundsätzlich ist das Hüftgelenk die Verbindung zwischen Femur und Becken. Damit der Gelenkkopf in der Gelenkpfanne, dem Acetabulum, gehalten wird, ist ein sehr starker Bandapparat notwendig. Dieser sorgt durch seine sensible Innervation auch für die meisten Schmerzprobleme. Die Gelenkkapsel wird von zwei Abkömmlingen des N. femoralis, die von den Mm. pectineus und iliopsoas zum anterolateralen Bereich ziehen, einer Faser des N. obturatorius, welche den anteromedialen Bereich abbildet und einer Faser des N. ischiadicus, die den posteromedialen Teil der Kapsel innerviert, versorgt. Die Existenz einer weiteren Faser aus dem Bereich des M. quadratus femoris und der N. gluteus superior wird ebenfalls diskutiert. Der wichtigste Teil, der verantwortlich ist für postoperative Schmerzen, wird im anterioren Bereich abgebildet. Es muss allerdings erwähnt werden, dass insbesondere die Anteile des N. femoralis meist schon oberhalb des Leistenbandes abgehen und die meisten “unserer” Blöcke zu weit distal injiziert werden, um sie adäquat zu betäuben. [27]
Fascia iliaca Block (FIB), infrainguinal
Ziel-Nerv:
- N. femoralis und N. cutaneus femoris lateralis
Blockart:
- Flächenblock
Indikationen:
- Oberschenkelhalsfrakturen, pertrochantäre Femurfrakturen, Femurschaftfrakturen
- Hier ist der Block sinnvoll, um die Patienten schmerzfrei umlagern zu können und eine schmerzfreie Lagerung für eine Spinalanästhesie zu ermöglichen
- (Bei Patellafraktur, Verletzungen oder Abszessen des anterioren Unterschenkels, wenn bei diesen Indikationen kein N. femoralis oder N. saphenus Block möglich ist)
- Bei elektiven orthopädischen Eingriffen, wie z. B. Hüftprothesen wird der Nutzen dieser Regionalanästhesie diskutiert. Dies folgt insbesondere daraus, dass die Blockade alleine nicht ausreicht, um die Schmerzen des ganzen OP-Gebietes zu nehmen, weil vornehmlich sensible Hautäste betäubt werden. Die Patient:innen können in der Regel auch so schmerzfrei gelagert und eingeschleust werden, weil keine Fraktur besteht.
Spezielle Kontraindikationen:
- Kompartmentsyndrom im Innervationsgebiet
Allgemeines:
Das Ziel der Infiltration bei diesem Block ist die Faszie oberhalb des M. iliopsoas, die nach lateral vom M. sartorius überlagert wird. Bei der Infiltration dieser Faszie mit einer größeren Menge Lokalanästhetikum kann durch die Verteilung sowohl der N. femoralis als auch der N. cutaneus femoralis lateralis anästhesiert werden.
Anatomie:
Beim N. femoralis handelt es sich um einen sowohl somatomotorisch als auch somatosensorischen Nerven. Er entspringt den Spinalnerven L1-L4 des Plexus lumbalis. Motorisch innerviert er den M. iliopsoas, den M. pectineus, den M. quadriceps femoris und den M. sartorius, also die Flexoren des Hüftgelenks. Die sensiblen Anteile verlaufen über die Rami cutanei anteriores zur Vorderseite des Oberschenkels und über den N. saphenus zur medialen Seite des Unterschenkels und Fußes.
Der N. cutaneus femoris lateralis ist ein rein sensibler Ast aus dem Plexus lumbalis. Er wird aus den Segmenten L2 und L3 gebildet und versorgt sensibel den äußeren Oberschenkel.
Sonoanatomie:
- Grüner Stern: Fascia iliaca
- Grüne Linien: Ausbreitung des Lokalanästhetikums
- SAR: M. sartorius
- IL: M. iliopsoas
- N: N. femoralis
- A: A. femoralis, nicht im Bild
Mögliche Komplikationen:
- Verletzung lageverwandter Leitungsbahnen (N. femoralis, A. femoralis, V. femoralis)
- Verletzung epigastrischer Gefäße
- Verletzung von Bauchorganen (eher unwahrscheinlich)
Durchführung:
Nach sicherer Identifizierung der Zielstruktur und der großen Gefäße wird die Schallsonde so positioniert, dass die Arteria femoralis am medialen Rand zu sehen ist. Die Punktion erfolgt in In-Plane-Technik von lateral nach medial gemäß Standardvorgehen. Der Nadelvorschub erfolgt unter Visualisierung der Spitze bis zum Durchstechen der Fascia iliaca (theoretisch ohne Ultraschall mit doppeltem Faszien-Click möglich). Nun wird das Aspirationsmanöver nach Standard durchgeführt und – nach der Injektion einer Probe von 1-2 ml verdünntem Lokalanästhetikum – kann bei sicherem Anheben der Faszie im Ultraschall der Rest des Lokalanästhetikums verabreicht werden.
Vorteile
- Sehr einfacher, auch für Anfänger:innen geeigneter Block
- Dieser Block kann auch im Rettungsdienst angewendet werden, wobei hier auf die Wirkungsdauer der verwendeten Lokalanästhetika zu achten ist. Im Rettungsdienst steht in der Regel nur Lidocain zur Verfügung, welches kurz wirksam ist und eine zeitnahe Beurteilung der Extremität erlaubt
- Ein drohendes Kompartmentsyndrom sollte nicht verschleiert werden
Nachteile:
- Erhöhtes Sturzrisiko postoperativ durch motorische Blockade der Hüftflektoren über den N. femoralis, insbesondere des M. quadriceps femoris
- Es kann nicht das ganze Hüftgelenk anästhesiert werden, da es auch durch sensorische Fasern vom N. ischiadicus innerviert wird, die nicht erreicht werden
Alternativen:
- PENG-Block
- Suprainguinaler FIB (bessere Abdeckung der proximalen N. femoralis Anteile der Gelenkkapsel), wird bei uns nicht angewendet, hier kann alternativ der PENG-Block genutzt werden
- N. femoralis-Block (fehlende Anästhesie im lateralen Oberschenkel, wo der Hautschnitt erfolgt)
- Opiate (sind häufig die schnellere Alternative)
Pericapsular Nerve Group (PENG-) Block
Ziel-Nerv:
- Proximale Abgänge des N. femoralis, des N. obturatorius und des N. obturatorius accessorius
Blockart:
- Flächenblock
Indikationen:
- Hüftgelenksnahe Frakturen, bis zur pertrochantären Fraktur des Acetabulums und der Rami superior und inferior des Os pubis
- Orthopädische Hüft-OPs, insbesondere Totalendoprothesen
Spezielle Kontraindikationen:
- Außer den allgemeinen Kontraindikationen existieren keine speziellen
Allgemeines:
Der PENG-Block wurde 2018 für die Hüft-Endoprothetik entwickelt. Der Vorteil dabei ist eine bessere Analgesie des Hüftgelenks bei erhaltener motorischer Funktion. Durch die Applikation proximal des Leistenbandes wird, im Vergleich zu anderen Blockaden im Hüftbereich, eine bessere Abdeckung der Hüftgelenksinnervation erreicht.
Anatomie:
Durch die suprainguinale Lage der Infiltrationsstelle werden alle drei Nerven, die den anterioren Teil der Hüftgelenkkapsel innervieren, zusammen anästhesiert. Auf Höhe der Spina iliaca anterior inferior und der Eminentia iliopubica finden sich die Kapseläste des N. femoralis und des N. obturatorius accessorius. Der Ast des N. obturatorius verläuft im inferomedialen Bereich des Acetabulums. Sonographisch wird sich auch anhand der Spina iliaca anterior inferior (engl. anterior inferior iliac spine AIIS) und der Eminentia iliopubica (engl. ilio pubic eminence, IPE) orientiert. Oberhalb der IPE ist die Sehne des M. psoas zu sehen, welche gut als Ziel auszumachen ist. [28]
Sonoanatomie:
- Grüner Stern: Infiltrationsstelle unterhalb der Sehne des M. psoas
- Grüne Striche: Ausbreitung des Lokalanästhetikums
- SMP: Sehne des M. psoas
- A: A. femoralis
- N: N. femoralis
- IL: M. iliacus
- PSO: M. psoas (wird anatomisch mit IL zum M. iliopsoas zusammengefasst)
- PEC: M. pectineus
- AIIS: anterior inferior iliac spine; Spina iliaca anterior inferior
- IPE: ilio pubic eminence; Eminentia iliopubica
Durchführung:
Nach sicherer Identifizierung der Zielstruktur und der großen Gefäße, wird die Schallsonde so positioniert, dass die Arteria femoralis am medialen Rand zu sehen ist. Bei dieser Blockade ist es sehr wichtig, dass die Schallsonde sicher und fest platziert wird, weil aufgrund des steilen Einstichwinkels eine Darstellung der Nadel erschwert ist. Die Punktion erfolgt in In-Plane-Technik von lateral nach medial gemäß Standardvorgehen. Der Nadelvorschub erfolgt unter Visualisierung der Spitze bis zum Knochenkontakt an der Eminentia iliopubica. Die Nadel wird nun ca 1-2 mm zurückgezogen und es werden Aspiration und Probeinjektion von 1-2 ml verdünntem Lokalanästhetikum durchgeführt. Bildet sich ein Flüssigkeitsspiegel an der gewünschten Stelle, kann der Rest des Lokalanästhetikums verabreicht werden.
Mögliche Komplikationen:
- Keine besonderen Komplikationen, außer den allgemeinen einer Regionalanästhesie
Vorteile:
- Erhaltene Motorik, daher geringeres Sturzrisiko und frühere Mobilisation
- Bessere analgetische Abdeckung durch Anästhesie der proximalen Äste, die die Gelenkkapsel innervieren
Nachteile:
- Der Anwender/ die Anwenderin muss deutlich erfahrener in der Nadelführung sein als beispielsweise beim FIB
- Insbesondere bei adipösen Patient:innen kann die Eindringtiefe des Linearschallkopfs nicht für eine gute Darstellung ausreichen
- Hier wäre alternativ auch ein Vorgehen mit dem Sektorschallkopf möglich, was allerdings noch mehr Übung erfordert
- Die Evidenz, insbesondere in Form von randomisierten kontrollierten Studien, steht zu einem großen Teil noch aus
Alternativen:
- Suprainguinaler FIB (schlechtere Anästhesie der Äste des N. obturatorius und des N. obturatorius accessorius und Nachteil der motorischen Blockade der Hüftextensoren im Bereich des N. femoralis)
- FIB (schlechtere Anästhesie der Äste des proximalen N. femoralis, N. obturatorius und des N. obturatorius accessorius und Nachteil der motorischen Blockade der Hüftextensoren im Bereich des N. femoralis)
- N. femoralis Block (Nachteil der motorischen Blockade der Hüftextensoren)
- Opiate (sind häufig die schnellere Alternative)
Nervus femoralis Block
Ziel-Nerv:
- N. femoralis
Blockart:
- Nervenblock
Indikationen:
- Femurfrakturen, insbesondere auch distal des Schenkelhalses
- Patellafrakturen
- Proximale Tibiafrakturen
- Anlage einer Blutsperre am Oberschenkel
Spezielle Kontraindikationen:
- Kompartmentsyndrom im Innervationsgebiet
Allgemeines:
Der N. femoralis bietet eine anatomisch einfach und leicht zu findende Struktur für eine Regionalanästhesie, weshalb seine Blockade sehr gut für Anfänger:innen anwendbar ist. Durch seinen relativ oberflächlichen und geradlinigen Verlauf eignet er sich auch sehr gut zur Anlage von Schmerzkathetern für die postoperative Analgesie.
In der Vergangenheit wurde bei Injektion größerer Mengen Lokalanästhetikums auch von einem 3-in-1-Block gesprochen, in der Annahme, dass sowohl der N. femoralis als auch der N. cutaneus femoris lateralis und der N. obturatorius anästhesiert werden. Letztlich kann bei der Injektion direkt am N. femoralis nur von einer sicheren Betäubung desselben Nerven ausgegangen werden.
Anatomie:
Unterhalb des Leistenbandes gliedern sich die Leitungsbahnen von medial nach lateral in die V. femoralis, die A. femoralis und den N. femoralis (IVAN). Daher kann die Lage des Nerven sehr gut anhand der Gefäße bestimmt werden. Er ist durch eine Faszie vom Kompartiment der Gefäße abgetrennt (Lacuna vasorum). Nach dorsal und lateral schließt sich der M. iliopsoas an.
Sonoanatomie:
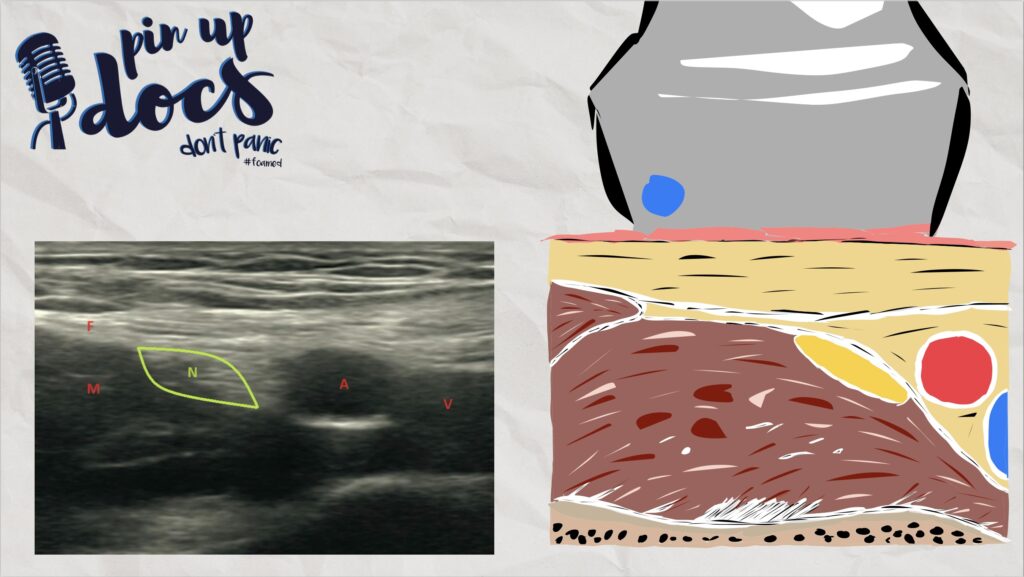
- N: N. femoralis
- A: A. femoralis
- V: V. femoralis
- M: M. iliopsoas
- F: Fascia iliaca
Mögliche Komplikationen:
- Höheres Risiko einer Gefäßpunktion, hier aber gut komprimierbar
- Dadurch besteht, insbesondere bei Katheteranlage, ein höheres Risiko für eine intravasale Lage
Durchführung:
Zum Identifizieren der Zielstruktur sollte man sich an der Lage der Femoralgefäße orientieren. Lateral hiervon verläuft der N. femoralis in der Leiste. Auch wenn er nicht immer einfach von dem umgebenden Bindegewebe abzugrenzen ist, stellt er sich in der Regel als dreieckige oder bohnenförmige Struktur dar. Die Punktion erfolgt von lateral in In-Plane-Technik, und beim Vorschieben der Nadel lassen sich zwei Faszienclicks spüren. Die Nadel wird zuerst, unter ständiger Visualisierung der Nadelspitze in Richtung des lateralen Nervenrandes, vorgeschoben. Nach dem zweiten Faszienclick und bei sicherer Visualisierung der Nadelspitze marginal unterhalb des Nerven kann eine Probeinjektion gemäß Standard erfolgen. Nach Lagebestätigung erfolgt die Gabe von bis zu 10 ml Lokalanästhetikum, wobei ein Auftreiben des Nerven zu sehen ist. Anschließend wird die Nadel oberhalb des Nerven geführt. Sodann erfolgt erneut eine Gabe von bis zu 10 ml Lokalanästhetikum.
Vorteile:
- Einfacher Block
- Gut für eine Katheteranlage geeignet
Nachteile:
- Motorische Blockade der Knieextensoren und damit eine mögliche erhöhte postoperative Sturzgefahr
- Der Katheter in der Leiste kann die Patient:innen stören
Alternativen:
- Eingriffe am Knochen im Bereich des Ober- oder Unterschenkels in alleiniger Regionalanästhesie sind in der Regel nicht möglich
- Um eine ausreichende Analgesie zu erwirken, kann eine Kombination aus Spinal- und Regionalanästhesie in Erwägung gezogen werden
- Alternativ auch über eine Kombination aus Allgemein- und Regionalanästhesie
- Bei Operationen am Unterschenkel sind in der Regel eine Kombination aus DIB und N. saphenus Block besser geeignet
- Für die Anästhesie hüftnaher Frakturen ist der PENG-Block oder der FIB in der Regel besser geeignet
Distaler Ischiadicus Block (DIB)
Ziel-Nerv:
- N. ischiadicus
Blockart:
- Nervenblock
Indikationen:
- Anästhesie im Bereich des lateralen, anterioren und posterioren Unterschenkels
- Tibiafraktur (CAVE: Bei geplanter Spongiosaplastik erfolgt die Entnahme von Knochenmaterial ggf. aus dem Becken; dieses wird natürlich nicht mit anästhesiert)
- Frakturen oder orthopädische Operationen am Fuß
- Knie-Totalendoprothese
- Kniearthroskopie
Spezielle Kontraindikationen:
- Kompartmentsyndrom am Unterschenkel
Allgemeines:
Der DIB ist ein Block mit einem sehr weiten Ausbreitungsgebiet. Der N. ischiadicus versorgt den kompletten Unterschenkel bis auf dessen medialen Anteil und den medialen Anteil des Fußes. Diese Gebiete wiederum liegen im Versorgungsgebiet des N. saphenus, weshalb die Blockaden beider Nerven häufig kombiniert werden. Zu bedenken ist, dass für Operationen in diesem Bereich häufig Blutsperren am Oberschenkel angelegt werden, der durch die oben beschriebene Regionalanästhesie natürlich nicht mit anästhesiert wird. Hier bietet sich entweder eine Kombination mit einer Spinalanästhesie oder eine zusätzliche Single-Shot-Anästhesie des N. femoralis an. Die Anlage eines Schmerzkatheters am N. ischiadicus lässt sich sehr gut durchführen, auch weil der Katheter die Patient:innen in dieser Position nicht stört. Hierbei ist wiederum auf die Blutsperre zu achten, weil der Schmerzkatheter beim Anbringen und Abdecken mit eingeschlossen werden kann. Besondere Vorsicht ist auch beim Entfernen der klebenden Abdeckung und der Blutsperre geboten.
Anatomie:
Der N. ischiadicus verläuft als dickster Nerv im menschlichen Körper vom Plexus sacralis ausgehend (L4-S3) durch das Foramen infrapiriforme entlang des distalen Oberschenkels, bis er sich im Bereich der Kniekehle in den N. fibularis communis und den N. tibialis aufteilt. Hier hat er eine direkte Lagebeziehung zur V. und A. poplitea, welche bei der Suche mit dem Ultraschallgerät gut als Anhaltspunkte dienen. Auf dem Weg gibt er mehrere Rami musculari ab, die insbesondere die Hüftextensoren, wie den M. biceps femoris, M. semitendinosus und den M. semimembranosus, versorgen.
Sonoanatomie:
- Grüner Kreis mit Stern: N. ischiadicus
Bereich der Bifurkation, Punktionsort weiter proximal
- Grüner Kreis: Bifurkation des N. ischiadicus in den N. femoralis communis (links) und den N. tibialis (rechts)
- VP: V. poplitea
Verlauf in der Kniekehle, Punktion sollte weiter proximal erfolgen.
- Grüner Kreis links: N. femoralis communis
- Grüner Kreis rechts: N. tibialis
- VP: V. poplitea
- AP: A. poplitea
Mögliche Komplikationen:
- Nervenschäden
Durchführung:
Disclaimer: In der hier geschilderten Methode wird das Epineurium des Nerven durchstochen. Dies geschieht bei uns in Bremerhaven mit einer stumpfen Tuohy-Nadel, um Nervenschäden zu vermeiden. Bei der Benutzung von scharfen Nadeln, sollte auf das Durchstechen verzichtet werden und eine Punktion distal der Bifurkation erfolgen, da die Diffusionsstrecke dort geringer ist. Ebenfalls ist zu beachten, dass es zu Druckschäden durch das applizierte Volumen kommen kann.
Zum Aufsuchen der Punktionsstelle orientieren wir uns an der A. poplitea, oberhalb welcher die Nn. fibularis communis und tibialis verlaufen. Um die Nerven besser identifizieren zu können, kann es sinnvoll sein, den Patienten/ die Patientin zu bitten, den Fuß auf und ab zu bewegen. Dies führt zu einem Auf- und Abwippen der beiden Nerven. Anschließend wird der Verlauf nach proximal bis zur Bifurkation verfolgt. Die Punktion erfolgt in In-Plane-Technik von lateral nach medial in ca. 2 cm Tiefe, 90° zur Schallebene. Zum Visualisieren der Nadelspitze kann es sein, dass der Schallkopf vom Nerven aus weiter nach lateral geführt werden muss, da die Breite des Schallkopfes nicht ausreicht, um den ganzen Stichverlauf darzustellen. Die Nadelspitze wird zum unteren lateralen Pol des Nerven geführt und das Epineurium durchstochen. Nach negativer Aspirationsprobe wird Lokalanästhetikum unter den Nerv gespritzt. Hierbei ist darauf zu achten, dass sich ein Depot bildet und der Nerv aufgeschwemmt wird. Anschließend muss die Nadel zurückgezogen werden, um zum oberen Pol des Nerven zu gelangen. Sodann ist das Vorgehen zu wiederholen.
In Rückenlage gestaltet sich das Abkleben einer sterilen Arbeitsfläche mit einer einzelnen Folie, die im Set enthalten ist, schwierig. Es lässt sich mit ihr dennoch eine sterile Arbeitsfläche schaffen. Die Punktion in Rückenlage bietet sich insbesondere bei Complianceproblemen seitens der Patient:innen an. Auf steriles Arbeiten ist explizit zu achten. Eine Out-of-Plane-Punktion, um einen Katheter direkt entlang des Nerven zu positionieren, ist in Rückenlage nicht möglich, sondern nur, wenn der Patient/ die Patientin auf dem Bauch liegt. Eine In-Plane-Anlage ist dennoch möglich. Alternativ kann für die Lagerung auch ein Göpelbeinhalter verwendet werden.
Um die Sterilität zu wahren, ist die Bauch- oder Seitenlage bei der Katheteranlage und bei geeigneten Patient:innen durchaus zu erwägen.
Vorteile:
- Da im direkten 90°-Winkel zur Schallebene gestochen wird, hat man eine sehr gute Nadelvisualisierung, häufig sogar mit Reverberationen
- Sehr breite Anästhesie am Unterschenkel
Nachteile:
- Das Durchstechen des Epineuriums proximal der Bifurkation sorgt für eine schnelle Wirkung, allerdings sind Nervenverletzungen möglich
- Wenn das Epineurium nicht durchstochen wird, kann die anästhetische Wirkung durch die Dicke des Bindegewebes abgeschwächt sein; dies lässt sich durch eine distale Punktion vermeiden
Alternativen:
- Im Fußbereich kann ein Fußblock vorgenommen werden
- Spinalanästhesie
Nervus saphenus Block
Ziel-Nerv:
- N. saphenus (distaler rein sensibler Ausläufer des N. femoralis am Unterschenkel)
Blockart:
- Flächenblock oder Nervenblockade je nach Höhe der Punktion
Indikationen:
- Anästhesie des medialen Unterschenkels
- Tibiafraktur
- Knie-Totalendoprothese
- Kniearthroskopie
- Fußchirurgie unter Berücksichtigung des 1. Strahls
Spezielle Kontraindikationen:
- Kompartmentsyndrom am Unterschenkel
Anatomie:
Im weiteren Verlauf des N. femoralis, nachdem alle Rami muscularis abgegangen sind, verläuft der Nerv als N. saphenus, mit rein somatosensiblen Anteilen, durch den Adduktorenkanal zum medialen Unterschenkel und weiter zum Fuß. Im proximalen Bereich wird der Nerv von der A. femoralis begleitet, welche zur Identifikation im Ultraschall dienen kann. Die Begrenzung des Adduktorenkanals sind nach ventral der M. vastus medialis, nach medial der M. sartorius und nach dorsal die Adduktoren.
Sonoanatomie:
Bei uns wird der N. saphenus relativ weit distal punktiert. Daher ist hier die A. femoralis nicht zu sehen, da sie bereits nach dorsal “abgetaucht” ist, um zur A. poplitea zu werden.
- Grüner Stern: Faszie des Adduktorenkanals; der N. saphenus kann in den meisten Fällen nicht dargestellt werden; eine Faszieninfiltration ist völlig ausreichend
- F: Femur
- VM: M. vastus medialis
- S: M. sartorius
- A: Adduktoren
- AF: A. femoralis
Mögliche Komplikationen:
- Keine besonderen
Durchführung:
Der Schallkopf wird ca. eine Handbreit proximal der Patella aufgesetzt und am Oberschenkel nach medial geführt, bis der M. sartorius und das darunter liegende Fasziendreieck sichtbar werden. Im Zweifel kann man dieses Dreieck nach proximal verfolgen, bis die A. femoralis zu sehen ist. Die Punktion erfolgt in In-Plane-Technik von ventral nach dorsal. Die Nadelspitze wird in die Faszie geführt und nach negativer Aspiration eine Probeinjektion durchgeführt. Man sollte eine Hydrodissektion der Faszienblätter erkennen. Bleibt diese aus, muss die Nadellage noch einmal korrigiert werden. Liegt die Nadel richtig, ist das LA-Depot zu injizieren.
Vorteile:
- Rein sensible Blockade im Vergleich zum N. femoralis Block
Nachteile:
- Keine
Alternativen:
- Spinalanästhesie
- N. femoralis Block (mit motorischer Blockade der Hüftflexoren)
- Im Fußbereich Fußblock
Fußblock
Ziel-Nerv:
- Alle sensiblen Endäste des N. tibialis, des N. femoralis communis (auch N. peronaeus communis) und des N. saphenus
Blockart:
- Flächenblock
Indikationen:
- Operationen an den Zehen oder am Vorfuß
- Insbesondere gut geeignet bei Amputationen und bei Patient:innen mit Polyneuropathie, weil sie die Einstiche nicht in jedem Fall bemerken
Spezielle Kontraindikationen:
- Außer den allgemeinen Kontraindikationen existieren keine speziellen
Allgemeines:
Der Fußblock ist eine einfache Methode, um ohne großen Aufwand und ohne Unterstützung von Geräten eine sehr wirksame Anästhesie zu erzielen.
Anatomie:
Die Bezeichnungen der genauen Endäste wollen wir in diesem Skript nicht im Detail aufführen. Letztlich ist der Weichteilmantel am Sprunggelenk sehr dünn, sodass alle Nerven oberflächlich verlaufen. Durch den Block werden alle Nerven erfasst. Die einzigen anatomischen Strukturen, die man identifizieren muss, sind die A. dorsalis pedis (Fußrücken) und die A. tibialis posterior (unterhalb des Malleolus medialis).
Sonoanatomie:
- Nach Landmarkentechnik
Mögliche Komplikationen:
- Keine spezifischen
Durchführung:
Hierfür wird kein Ultraschall benötigt. Initial ertastet man die A. dorsalis pedis und injiziert 3-4 ml LA lateral und medial. Gleiches Procedere ist auch bei der A. tibialis posterior vorzunehmen. Anschließend appliziert man einen Wall aus LA zirkulär um das Sprunggelenk; dazu werden immer wieder 2 ml LA in einem Abstand von 1-1,5 cm injiziert.
Vorteile:
- Schnell und ohne Geräteeinsatz durchzuführen
Nachteile:
- Keine
Alternativen:
- DIB mit N. saphenus Block
- Spinalanästhesie
Rumpf
Transversus Abdominis Plane (TAP-) Block
Ziel-Nerv:
- Dermatome der Spinalnerven von ca. Th 8 bis L1
- N. iliohypogastricus (Th12-L1)
Blockart:
- Flächenblock
Indikationen:
- Rescue-Block nach Laparotomie!
- Wenn PDK-Anlage frustran, kontraindiziert oder durch den Patienten / die Patientin abgelehnt wurde
- Sectiones seien hier nochmal explizit genannt
- Laparoskopische Eingriffe
Spezielle Kontraindikationen:
- Außer den allgemeinen Kontraindikationen existieren keine speziellen
Allgemeines:
Der TAP-Block ist einer der Lieblingsblöcke der Autor:innen. Man benötigt zwar etwas Übung in der Koordination von Schallkopf und Nadel, dafür ist der mit dem Block zu erzielende Effekt ausgesprochen hoch. Insbesondere wenn es nicht möglich ist, einen PDK zu legen, oder wenn der gelegte PDK nicht den gewünschten Effekt erzielt, sollte man sich ins Bewusstsein rufen, dass der TAP-Block eine vergleichbare Wirkung erzielen kann. [29]
Anatomie:
Die Spinalnerven, welche im thorakalen Bereich in die Subcostalnerven auslaufen, sind auch für die Innervation der Bauchwand zuständig. Hierbei wird bekannterweise die Haut in Dermatome unterteilt. Von den jeweiligen Subcostalnerven ziehen laterale und anteriore Rami weiter, die das entsprechende Dermatom sensibel innervieren. Diese Nervenäste verlaufen anatomisch in der Faszie zwischen dem M. obliquus internus und dem M. transversus abdominis. Das Gleiche gilt für den ersten Nerven des Plexus lumbalis, den N. iliohypogastricus, welcher das Dermatom L1 innerviert. Durch die Injektion einer großen Menge Lokalanästhetikums in diese Faszie kann durch die Ausbreitung des Volumens der Bereich der Dermatome Th8 bis L1 anästhesiert werden. Um einen entsprechend großen Bereich zu betäuben, muss die Injektion weit lateral direkt zwischen Beckenkamm und Rippenbogen stattfinden (siehe Bebilderung).
Sonoanatomie:
- Grüner Stern: Faszie zwischen OI und TA
- Grüne Linien: Ausbreitung des Lokalanästhetikums
- OE: M. obliquus externus
- OI: M. obliquus internus
- TA: M. transversus abdominis
- P: Peritoneum
Mögliche Komplikationen:
- Punktion des Peritoneums und etwaiger intraabdomineller Organe
- Verletzung der epigastrischen Gefäße
Durchführung:
Der Ultraschallkopf wird zwischen Beckenkamm und Rippenbogen in der Flanke aufgesetzt, sodass ein transversales Schnittbild entsteht (s. Abbildung). Die Darstellung wird so optimiert, dass die Dreischichtung aus M. obliquus externus, internus und transversus abdominis sichtbar ist. Die Nadel wird in In-Plane-Technik unter strikter Visualisierung der Nadelspitze in die Faszie zwischen M. obliquus internus und M. transversus abdominis geführt. Es wird nach einer negativen Aspirationsprobe eine geringe Menge Lokalanästhetikum verabreicht und eine Hydrodissektion sollte zu sehen sein. Ist eine ausreichende Hydrodissektion zu erkennen, kann ein großes LA-Depot (ca. 20 ml Volumen) injiziert werden.
Vorteile:
- Sehr effektive Anästhesie
Nachteile:
- Man braucht Erfahrung mit der Koordination von Schallkopf und Nadel
- Bei ausgeprägtem Weichteilmantel oft sehr erschwerte sonoanatomische Darstellung
Alternativen:
- PDK
- Spinalanästhesie
- Paravertebralblockade
- Erector spinae Blockade
- Kontinuierliche Wundinfiltrationssysteme (z.B. Pajunk-Katheter)
Erector spinae Blockade
Ziel-Nerven:
- Rami dorsalis der Spinalnerven
Blockart:
- Flächenblockade
Indikationen:
- Thoraxdrainagen in Bülau-Position
- Rippen- oder Rippenserienfrakturen
Spezielle Kontraindikationen:
- Motorische Unruhe
- Knöcherne Verletzungen im Bereich der Wirbelsäule
Allgemeines:
Technisch unkompliziert, jedoch kann die Zielstruktur in großer Tiefe liegen, was bei Nadeln ohne speziellen Sonoschliff eine Visualisierung extrem erschwert. In diesem Falle sollte keine Punktion erfolgen.
Anatomie:
Da die meisten Thoraxdrainagen im Safe-Triangle gelegt werden, handelt es sich in der Regel um den 4. bis 6. Intercostalraum. Für Thoraxdrainagen in Monaldi-Position, welche nicht notfallmäßig durchgeführt werden sollten (große Verletzungsgefahr der Vasa subclaviae), ist dieser Block unzureichend (hier eher paravertebrale Blockade). Vom Vertebra prominens kann die Wirbelsäule nach kaudal mit dem Schallkopf verfolgt und somit die richtige Höhe ermittelt werden. Bei schlanken Patient:innen lässt sich die Position auch ertasten oder sogar optisch anhand der Processus spinosi abzählen. Als Landmarken können in Neutralposition noch die Spina scapulae (ca. Th3) und der Angulus inferior scapulae (ca. Th7) genutzt werden. Die Ausprägung von Musculus trapezius, Rhomboidalmuskulatur und Erector spinae Muskulatur kann sehr unterschiedlich sein.
Sonoanatomie:
Sichtbar sollten Rippe 4 und 5 sein, dazwischen das Pleurafenster und die über den Rippen geschichtete Erector spinae-, Trapezius- und Rhomboidalmuskulatur.
Jetzt gleitet der Schallkopf in medialer Richtung, bis die Pleura aus dem Schallfenster verschwindet und der Processus transversus des Vertebra Th 4 erscheint. Sichtbar von schallkopfnah zu schallkopffern sind: M. trapezius, M. rhomboideus, Mm. Erector spinae, Processus transversus. Neben dem Processus transversus kann noch der Prävertebralraum und das Ligamentum costotransversarium zu sehen sein; für diese Blockade jedoch nicht obligat zu visualisieren.
- Identifizierung eines Interkostalraums
- Ri: Rippe
- T: M. trapezius
- R: M. rhomboideus
- E: M. erector spinae
- Roter Strich: Pleura
- PT: Processus transversus
- E: M. erector spinae
- T: M. trapezius
- Grüner Stern: Infiltrationsbereich
Mögliche Komplikationen:
- Verletzung der Pleura
Durchführung:
In-Plane-Nadelvorschub gemäß Standardvorgehen. Zielstruktur ist die Oberfläche des Processus transversus. Bei Knochenkontakt wird die Nadel einen Millimeter zurückgezogen. Nach erfolgter Probeinjektion ist der Bolus unter verringertem Schallkopfdruck zu injizieren, um eine gute Ausbreitung des Lokalanästhetikums zu erlauben. Nach ausreichender Hydrodissektion, lässt sich in diesem Bereich auch ein Katheter platzieren. Hierbei sollte eine sonographische Lagekontrolle erfolgen.
Vorteile:
- Deutlich geringeres Verletzungspotenzial der Pleura als bei der Paravertebralblockade
Nachteile:
- Geringere analgetische Potenz; häufig werden nur 1-2 Rami dorsales betäubt und es bleiben Schmerzen bestehen
- Bei größeren Rippenserienfrakturen, doppelter Thoraxdrainageneinlage (Monaldi und Bülau) oder geplanter Thorakotomie ist eher ein paravertebrales Vorgehen mit Kathetereinlage anzustreben
Alternativen:
- PEC 1/2 Blockade
- Paravertebralblockade
- Serratus anterior Plane Block
- Periduralanästhesie
Paravertebrale Blockade
Ziel-Nerv:
- Intercostalnerven, unilateral
Blockart:
- Mehretageninfiltration
Indikationen:
- Thoraxchirurgie
- Analgesie bei Rippen-/Rippenserienfrakturen
Spezielle Kontraindikationen:
- Antikoagulantien (Es sollten die selben zeitlichen Abstände wie bei peridualen, zentralen neuroaxialen Verfahren eingehalten werden)
Allgemeines:
- Erfordert erhöhte Expertise, erhöhtes Komplikationsrisiko bei technischen Unsauberkeiten
Anatomie:
Die paravertebrale Blockade ist im Bereich der thorakalen Wirbelsäule anwendbar. Vom Vertebra prominens kann die Wirbelsäule nach kaudal mit dem Schallkopf verfolgt und somit die richtige Höhe ermittelt werden. Bei schlanken Patient:innen lässt sich die Position auch ertasten oder sogar optisch anhand der Processus spinosi abzählen. Als Landmarken dienen in Neutralposition noch die Spina scapulae (ca. Th3) und der Angulus inferior scapulae (ca. Th7). Hinweis: Musculus trapezius, Rhomboidalmuskulatur und Erector spinae Muskulatur können sehr unterschiedlich ausgeprägt sein.
Sonoanatomie:
Paravertebrale longitudinale Schallkopfposition mit mittig eingestelltem Pleurafenster. Gewünschte Höhe der Blockade wählen. CAVE: Durch den Bolus kann sich der Block auch in sitzender Position nach kranial ausbreiten. Darzustellen ist: Im gewünschten Intercostalraum das Pleurafenster und über den Rippen die geschichtete Erector spinae-, Trapezius- und Rhomboidalmuskulatur.
Jetzt gleitet der Schallkopf in medialer Richtung, bis der Processus transversus des unteren Vertebra erscheint. Sichtbar von schallkopfnah zu schallkopffern: M. trapezius, (M. rhomboideus, M. latissimus dorsi) M. erector spinae, Processus transversus. Neben dem Processus transversus muss nun der Prävertebralraum und das Ligamentum costotransversarium visualisiert werden. Die Begrenzungen des Paravertebralraums sind das Ligamentum costotransversarium laterale (dorsal), die laterale Kante des Wirbelkörpers (medial) sowie die Pleura parietalis (ventral). Nach lateral geht der Paravertebralraum in den Interkostalspalt über. Die Punktion erfolgt nahezu parallel zur Pleura von lateral nach medial. Die Nadelspitze sollte nach Penetration des Ligamentum costotransversarium laterale nur noch wenige Millimeter unter Sicht vorgeschoben werden, um die Wahrscheinlichkeit einer Pleuraverletzung zu minimieren. Die Punktion erfolgt am Oberrand der Rippe, um die Wahrscheinlichkeit einer Gefäßverletzung zu reduzieren. Der Paravertebralraum ist nach kranial und kaudal durchlässig, weshalb eine Blockade auf mehreren Leveln möglich ist.
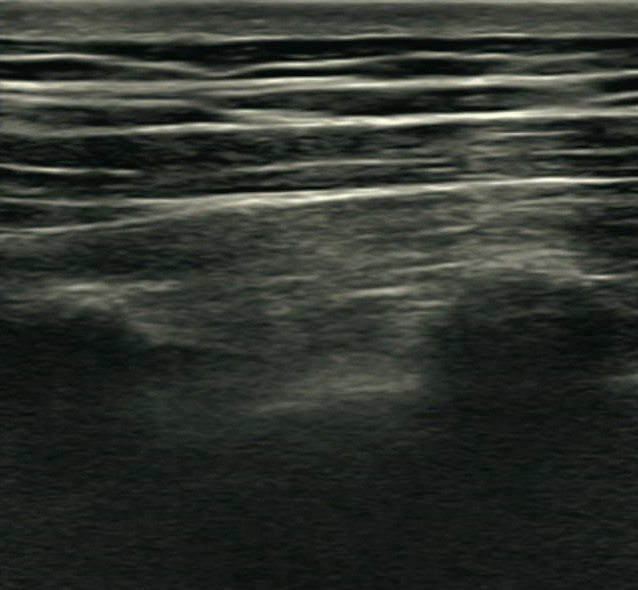
- Identifizierung eines Interkostalraums
- Ri: Rippe
- T: M. trapezius
- R: M. rhomboideus
- E: M. erector spinae
- Roter Strich: Pleura
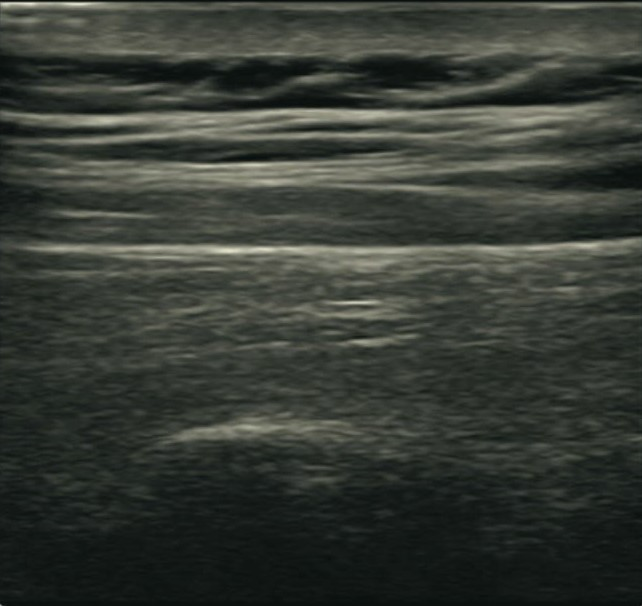
- PT: Processus transversus
- E: M. erector spinae
- T: M. trapezius
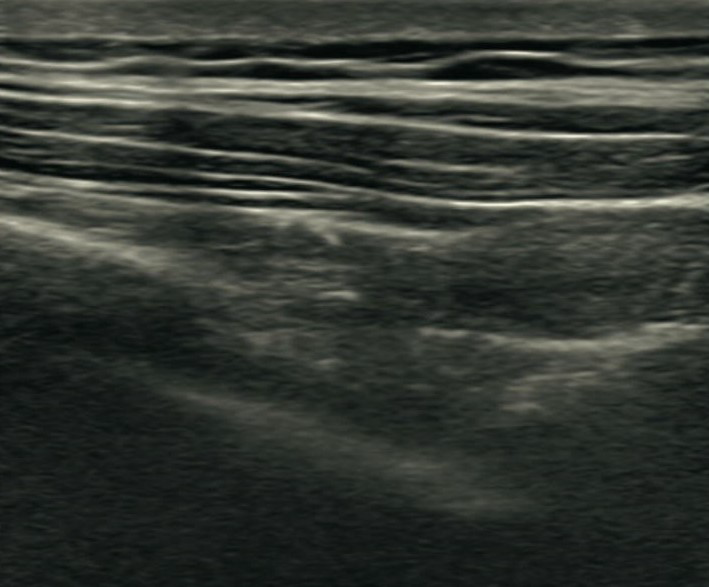
- Grüner Kreis: Paravertebralraum, Zielbereich
- Ri: Rippe, laterale Begrenzung
- Pl: Pleura, profunde Begrenzung
- PT: Processus transversus, mediale Begrenzung
- L: Ligamentum costo-transversarium, superficiale Begrenzung, muss durchstochen werden
Mögliche Komplikationen:
- Verletzung der Pleura
- Verletzung von intercostalen Gefäßen
- Kontralaterale Epiduralanästhesie bei vermehrter Infiltration des Foramen intervertebrale
- Intrathekale Injektion sowie ein temporäres Horner-Syndrom
Durchführung:
In-Plane-Nadelvorschub gemäß Standardvorgehen. Zielstruktur ist der Paravertebralraum mit den oben genannten Begrenzungen. Die laterale Oberfläche des Processus transversus kann sehr gut als Orientierung für den Nadelvorschub dienen. Dieser sollte penibel unter Sicht erfolgen und unter ständiger Visualisierung des Ligamentum costotransversarium laterale. Nach der Penetration dieses Bandes wird die Nadel nur noch wenige Millimeter vorgeschoben. Bei der Infiltration lässt sich bei guten sonographischen Sichtbedingungen das „Bulking“ (Ausbeulen) der Pleura erkennen. Nach Infiltrationsbolus ist die Anlage eines Katheters in den Paravertebralraum möglich. Bei uns in Bremerhaven gilt bei Katheterverfahren jeder Art, dass der Katheter nicht mehr als 5 Zentimeter über die Nadelspitze vorgeschoben werden sollte, um das Risiko eines falschen Abbiegens oder Abknickens des Katheters zu minimieren.
Vorteile:
- Analgesie und Anästhesie möglich
- Infiltration mehrerer Ebenen möglich
- Im Vergleich zur Peridualanästhesie statistisch geringeres Nebenwirkungsprofil, geringere Ausprägung von vegetativen Nebenwirkungen
Nachteile:
- Technisch hoch anspruchsvolles Verfahren
- Antikoagulationspausen sind einzuhalten
Alternativen:
- PEC 1/2 Blockade
- Erector spinae Blockade
- Serratus anterior Plane Block
- Periduralanästhesie
Pectoralis Blockade 1 und 2 (PEC 1/2)
PEC 1
Ziel-Nerv:
Nervi pectoralis medialis und lateralis
Blockart:
- Flächenblockade
Indikationen:
- Mammachirurgie
- Port- und Demerskatheteranlagen
- Thoraxdrainagen in Monaldiposition
- Axilläre ventrale Lymphknotenextirpation
Spezielle Kontraindikationen:
- Außer den allgemeinen Kontraindikationen existieren keine speziellen
Allgemeines:
- Technisch unkompliziertes Verfahren
PEC 2
Zusätzliche Ziel-Nerven:
- Nervus intercostobrachialis (sensibler Anteil des zweiten Intercostalnerven)
- Kutane Äste der Intercostalnerven
Blockart:
- Flächenblockade
Zusätzliche Indikationen:
- Thoraxdrainagen in Bülauposition
- Axilläre Lymphknotenextirpation
Spezielle Kontraindikationen:
- Außer den allgemeinen Kontraindikationen existieren keine speziellen
Allgemeines:
- Technisch unkompliziertes Verfahren
Anatomie:
Als Landmarke bietet sich das Aufsuchen des Übergangs zwischen mittlerem und lateralem Drittel der Clavicula an. Der Musculus subclavius und der M. pectoralis minor werden von der Fascia clavipectoralis eingeschlossen. Darüber gleitet der M. pectoralis major. Die Faszie wird von den lateralen und medialen Nn. pectorali durchbohrt, die somit über einen Flächenblock infiltriert werden können. Darunter liegt der M. sartorius anterior der Thoraxwand an. Zwischen M. sartorius anterior und der Fascia clavipectoralis erreicht man zusätzlich zu den Nervi pectoralis medialis und lateralis noch den Nervus intercostobrachialis und kutane Äste der Intercostalnerven, weshalb eine Infiltration hier eine deutlich größere Ausbreitung erzielt.
Sonoanatomie:
Der Schallkopf sollte in longitudinaler Ausrichtung, circa zwischen lateralem und mittlerem Drittel auf der Clavicula, aufgesetzt werden. Bewegt man den Schallkopf nun nach kaudal, lässt sich in manchen Fällen noch kranial die Arteria und Vena subclavia im Querschnitt erkennen. Die rostrale Gefäßwand der Vena subclavia ist mit der Zielstruktur der Fascia clavipectoralis verwachsen. Um eine akzidentelle Gefäßverletzung auszuschließen, sollte der Schallkopf weiter nach kaudal bewegt werden, bis die Gefäße sich nicht mehr im Schallfenster befinden. Auf ausreichenden Abstand ist zu achten. Zu identifizieren sind der M. pectoralis major unter dem subkutanen Fettgewebe, bei Patient:innen der Drüsenkörper und weiter in der Tiefe die kranialen Anteile des M. pectoralis minor in der Fascia clavipectoralis. Teilweise kann, der Faszie aufliegend, der pectorale Anteil der Arteria thoracoacromialis dargestellt werden. Weiter in der Tiefe sollten Rippen, intercostale Muskulatur und Pleura identifiziert werden. Nach Identifikation lässt sich die Eindringtiefe wieder reduzieren, um die Zielstrukturen besser darzustellen. Beim PEC 2 gleitet der Schallkopf nun nach laterokaudal bis auf Höhe der 4./5. Rippe. Hier stellt sich unter dem Musculus pectoralis minor eine dritte Muskelschicht dar; dies ist der Musculus serratus anterior.
- Ri: Rippe
- Pl: Pleura
- I: Interkostalmuskulatur
- S: M. serratus anterior
- Min.: M. pectoralis minor
- Maj.: M. pectoralis major
- Grüne Linie: Zielbereich
- Ri: Rippe
- Pl: Pleura
- I: Interkostalmuskulatur
- S: M. serratus anterior
- Min.: M. pectoralis minor
- Maj.: M. pectoralis major
- Grüne Linie: Zielbereich
Mögliche Komplikationen:
- Verletzung von Pleura
- Akzidentelle Gefäßpunktion
Durchführung:
- In-Plane-Punktionstechnik gemäß Standvorgehen. Sehr selten sind Katheterverfahren notwendig
Vorteile:
- Technisch einfache Punktion
- Identifikation zum Teil erschwert bei geringer Ausprägung des Serratus anterior
- Seltene Komplikationen
Nachteile:
- Bei größeren Rippenserienfrakturen, doppelter Thoraxdrainageneinlage (Monaldi und Bülau) oder geplanter Thorakotomie ist wegen der Schmerzdauer eher ein paravertebrales Vorgehen mit Kathetereinlage anzustreben.
Alternativen je nach Indikation:
- Pectoralis Blockade 1 (PEC 1)
- Paravertebralblockade
- Serratus anterior Plane Block
- Periduralanästhesie
Schlusswort
Die Regionalanästhesie bietet ein vielseitiges und wirkungsvolles Instrument in der modernen Anästhesie – von der gezielten Schmerztherapie bis zur vollständigen chirurgischen Anästhesie. In diesem Beitrag haben wir exemplarisch einen möglichen Weg durch die Vielzahl an Techniken und Konzepten aufgezeigt – wohlwissend, dass es nicht den einen richtigen Weg gibt. Klinische Erfahrung, Patientenkontext und individuelle Präferenzen spielen eine zentrale Rolle bei der Wahl der passenden Methode. Regionalanästhesie ist wie guter Kaffee – viele Zubereitungsarten, Hauptsache am Ende wirkt’s.
In Anlehnung an die letzte Regel aus The House of God – „The delivery of good medical care is to do as much nothing as possible“ – bleibt auch in der Regionalanästhesie die Kunst darin, mit möglichst gezielten, durchdachten Maßnahmen ein Maximum an Nutzen zu erreichen. Gute Planung, fundiertes anatomisches Wissen und eine sorgfältige Durchführung ermöglichen oft mehr, als zusätzliche Interventionen es je könnten.
Dr. Gerrit Herpertz, Mattis Bengsch, Luer Luerßen, Hanna Kantsevaya, Aliaksei Kantsevoi, Artenisa Zeka, Dr. Dana Maresa Haag
Die Regionalanästhesie lebt vom Detail, aber auch von Ruhe, Übersicht und Respekt vor der Anatomie – und vor den Patient:innen.
Schematische Abbildungen:
Dr. Thorben Doll, Dr. Dana Maresa Haag
Interessenskonflikte:
Herr Mattis Bengsch hat einmalig ein Honorar von Pajunk für Ultraschalldemonstrationen auf Messen erhalten.
Alle weiteren Autor:innen geben an, keine Interessenskonflikte zu haben.
Danksagung:
Wir danken allen Mitwirkenden und Beteiligten, die nicht namentlich genannt wurden für die Hilfe, Unterstützung und vielen wichtigen Anmerkungen.
Quellen:
Einzelquellen im Text
[1] Memtsoudis SG, Poeran J, Cozowicz C, Zubizarreta N, Ozbek U, Mazumdar M. The impact of peripheral nerve blocks on perioperative outcome in hip and knee arthroplasty-a population-based study. Pain. 2016 Oct;157(10):2341-2349. doi: 10.1097/j.pain.0000000000000654 . PMID: 27643835
.
[2] Malchow RJ, Gupta RK, Shi Y, Shotwell MS, Jaeger LM, Bowens C. Comprehensive Analysis of 13,897 Consecutive Regional Anesthetics at an Ambulatory Surgery Center. Pain Med. 2018 Feb 1;19(2):368-384. doi: 10.1093/pm/pnx045 . PMID: 28371877
.
[3] Edwards DA, Hedrick TL, Jayaram J, Argoff C, Gulur P, Holubar SD, Gan TJ, Mythen MG, Miller TE, Shaw AD, Thacker JKM, McEvoy MD; POQI-4 Working Group. American Society for Enhanced Recovery and Perioperative Quality Initiative Joint Consensus Statement on Perioperative Management of Patients on Preoperative Opioid Therapy. Anesth Analg. 2019 Aug;129(2):553-566. doi: 10.1213/ANE.0000000000004018 . PMID: 30768461
.
[4] McCombe K, Bogod D. Regional anaesthesia: risk, consent and complications. Anaesthesia. 2021 Jan;76 Suppl 1:18-26. doi: 10.1111/anae.15246 . PMID: 33426664
.
[5] Höhener D, Blumenthal S, Borgeat A. Sedation and regional anaesthesia in the adult patient. Br J Anaesth. 2008 Jan;100(1):8-16. doi: 10.1093/bja/aem342 . PMID: 18070783
.
[6] Kopp SL, Jacob AK, Hebl JR. Regional Anesthesia in Patients With Preexisting Neurologic Disease. Reg Anesth Pain Med. 2015 Sep-Oct;40(5):467-78. doi: 10.1097/AAP.0000000000000179 . PMID: 26115188
.
[7] Watts SA, Sharma DJ. Long-term neurological complications associated with surgery and peripheral nerve blockade: outcomes after 1065 consecutive blocks. Anaesth Intensive Care. 2007 Feb;35(1):24-31. doi: 10.1177/0310057X0703500103 . PMID: 17323662
.
[8] Kessler, P., Steinfeldt, T., Gogarten, W. et al. Periphere Regionalanästhesie beim Patienten in Allgemeinanästhesie. Anaesthesist 62, 483–488 (2013). https://doi.org/10.1007/s00101-013-2190-x
[9] Zeng H, Sanes JR. Neuronal cell-type classification: challenges, opportunities and the path forward. Nat Rev Neurosci. 2017 Sep;18(9):530-546. doi: 10.1038/nrn.2017.85 . Epub 2017 Aug 3. PMID: 28775344
.
[10] trichartz G. Molecular mechanisms of nerve block by local anesthetics. Anesthesiology. 1976 Oct;45(4):421-41. doi: 10.1097/00000542-197610000-00012. PMID: 9844 .
[11] Wildsmith JA. Axonal sensitivity and block dynamics. Reg Anesth Pain Med. 2025 Mar 5;50(3):280-282. doi: 10.1136/rapm-2024-105950. PMID: 39542639.
[12] Ode K, Selvaraj S, Smith AF. Monitoring regional blockade. Anaesthesia. 2017 Jan;72 Suppl 1:70-75. doi: 10.1111/anae.13742 . PMID: 28044336
.
[13] Cohen CCH, Popovic MA, Klooster J, Weil MT, Möbius W, Nave KA, Kole MHP. Saltatory Conduction along Myelinated Axons Involves a Periaxonal Nanocircuit. Cell. 2020 Jan 23;180(2):311-322.e15. doi: 10.1016/j.cell.2019.11.039 . Epub 2019 Dec 26. PMID: 31883793
; PMCID: PMC6
978798.
[14] Pharmakologie und Toxikologie; 33. Auflage, Karow, Lang, ISBN 978-3-9821223-4-2
[15] Chin A, Heywood L, Iu P, Pelecanos AM, Barrington MJ. The effectiveness of regional anaesthesia before and after the introduction of a dedicated regional anaesthesia service incorporating a block room. Anaesth Intensive Care. 2017 Nov;45(6):714-719. doi: 10.1177/0310057X1704500611 . PMID: 29137582
.
[16] Desai, N., Kirkham, K.R. and Albrecht, E. (2021), Local anaesthetic adjuncts for peripheral regional anaesthesia: a narrative review. Anaesthesia, 76: 100-109. https://doi.org/10.1111/anae.15245
[17] Comparison of the effects of perineural or intravenous dexamethasone on low volume interscalene brachial plexus block: a randomised equivalence trial McHardy, Paul G. et al. British Journal of Anaesthesia, Volume 124, Issue 1, 84 – 91. DOI: 10.1016/j.bja.2019.08.025
[18] Dexamethasone as an adjuvant for peripheral nerve blockade: a randomised, triple-blinded crossover study in volunteers Marhofer, Peter et al. British Journal of Anaesthesia, Volume 122, Issue 4, 525 – 531. DOI: 10.1016/j.bja.2019.01.004
[19] Helander EM, Kaye AJ, Eng MR, Emelife PI, Motejunas MW, Bonneval LA, Terracciano JA, Cornett EM, Kaye AD. Regional Nerve Blocks-Best Practice Strategies for Reduction in Complications and Comprehensive Review. Curr Pain Headache Rep. 2019 May 23;23(6):43. doi: 10.1007/s11916-019-0782-0. PMID: 31123919.
[20] Borgeat A. Neurologic deficit after peripheral nerve block: what to do? Minerva Anestesiol. 2005 Jun;71(6):353-5. PMID: 15886600 .
[21] Lee, H. M. D., Archer, J. R. H., Dargan, P. I., & Wood, D. M. (2015). What are the adverse effects associated with the combined use of intravenous lipid emulsion and extracorporeal membrane oxygenation in the poisoned patient? Clinical Toxicology, 53(3), 145–150. https://doi.org/10.3109/15563650.2015.1004582
[22] Wiesmann T, Schubert A-K, Volk T, Kubulus C, Zausig Y, Graf BM et al: S1-Leitlinie:
Prävention & Therapie der systemischen Lokalanästhetika-Intoxikation (LAST). Aktualisierte Handlungs-
empfehlungen der DGAI. Anästh Intensivmed 2020;61:225–238. DOI: 10.19224/ai2020.225
[23] Padaki AS, Fitch RW, Stack LB, Thurman RJ. Horner’s Syndrome after Scalene Block and Carotid Dissection. J Emerg Med. 2016 May;50(5):e215-8. doi: 10.1016/j.jemermed.2016.01.027 . Epub 2016 Feb 15. PMID: 26899514
.
[24] El-Boghdadly K, Chin KJ, Chan VWS. Phrenic Nerve Palsy and Regional Anesthesia for Shoulder Surgery: Anatomical, Physiologic, and Clinical Considerations. Anesthesiology. 2017 Jul;127(1):173-191. doi: 10.1097/ALN.0000000000001668 . PMID: 28514241
.
[25] Meulemans RJ, Gerritse BM. Acute reversal of respiratory distress after a preoperative single-shot interscalene nerve block. Reg Anesth Pain Med. 2024 Jul 16:rapm-2024-105728. doi: 10.1136/rapm-2024-105728. Epub ahead of print. PMID: 39019503.
[26] Gauss A, Tugtekin I, Georgieff M, Dinse-Lambracht A, Keipke D, Gorsewski G. Incidence of clinically symptomatic pneumothorax in ultrasound-guided infraclavicular and supraclavicular brachial plexus block. Anaesthesia. 2014 Apr;69(4):327-36. doi: 10.1111/anae.12586 . PMID: 24641639
.
[27] Wiseman P., O’Riordan M. Pericapsular Nerve Group Block: An Evidence-Based Discussion. DOI: 10.28923/atotw.478
[28] Berlioz B., Bojaxhi E. Peng Regional Block https://www.ncbi.nlm.nih.gov/books/NBK565870/
[29] Y J Xu, X Sun, H Jiang, Y H Yin, M L Weng, Z R Sun, W K Chen, C H Miao, Randomized clinical trial of continuous transversus abdominis plane block, epidural or patient-controlled analgesia for patients undergoing laparoscopic colorectal cancer surgery, British Journal of Surgery, Volume 107, Issue 2, January 2020, Pages e133–e141, https://doi.org/10.1002/bjs.11403
[30] Wiesmann, T. et al; S1- Leitlinie (AWMF-Registernummer 001-044) – Hygieneempfehlungen für die Regionalanästhesie; April 2025 https://register.awmf.org/assets/guidelines/001-014l_S1_Hygieneempfehlungen-Regionalanaesthesie_2025_06_1.pdf
