Basics – Sepsis & Update 2020

- Schon wieder Sepsis ? Warum ?
- Kann man gar nicht oft genug erzählen
- Gerade neue S3-Leitlinie erschienen
- Wird immer noch oft übersehen !

Was ist Sepsis ?
- Lebensbedrohliche Organdysfunktion, die durch fehlregulierte Reaktion des Organismus auf Infektion verursacht wird
- Septischer Schock -> für MAD > 65 mmHG sind Katecholamine erforderlich & Serumlaktat > 2 mmol/l
- Organdysfunktion definiert als infektionsbedingter Anstieg des SOFA-Scores um mind. 2 Punkte (Sequential Organ Failure Assessment Score)
| Organ | Parameter | 1 Punkt | 2 Punkte | 3 Punkte | 4 Punkte |
| Lunge | P2O2/FiO2 | <400 | <300 | <200 (Beatmung) | <100 (Beatmung) |
| Niere | Kreatinin (mg/dl) | 1,2-1,9 | 2,0-3,4 | 3,5 -4,9 bzw. Oligurie | >5 bzw. Anurie |
| Leber | Bilirubin (mg/dl) | 1,2-1,9 | 2,0 – 5,9 | 6 -11,9 | >12 |
| Kreislauf | MAD (mmHG) | <70 | Niedrige Katecholamine | Mittlere Katecholamine | Hohe Katecholamine |
| Blutbild | Thrombozyten | <150 | <100 | <50 | <20 |
| ZNA | GCS | 13-14 | 10-12 | 6-9 | <6 |
Screening-Scores:
- qSOFA – hat aber niedrige Spezifität -> erkennt eher kritisch kranke Patienten -> Unser Artikel dazu !
| Kriterium | Wert | Punkte |
| Veränderter mentaler Status | GCS <15 | 1 |
| Atemfrequenz | AF > 22/min | 1 |
| Hypotonie | RRsys < 100 mmHG | 1 |
Wenn 2 Kriterien erfüllt dann positiv und Mortaltätsanstieg auf das 3-14 fache, je nach untersuchtem Kollektiv
- Alternative NEWS-Score (National Early Warning Score)
- Nicht Sepsis-Spezifisch
- Es geht eher darum, kritisch kranke schnell zu identifizieren


SIRS
- Kein Eingang mehr in aktuelle Sepsis-Definition
- Aber hilfreich für Diagnosestellung einer akuten Infektion
SIRS-Kriterien:
- Fieber (>38,0 °C) oder Hypothermie (< 36,0 °C)
- Tachykardie ( > 90 /min)
- Tachypnoe (AF > 20/min) oder Hyperventilation (paCO2 < 33 mmHG)
- Leukozytose (>12.000/ml) oder Leukopenie (<4000 /ml) oder mehr als 10 % unreife Neutrophile im Diff-Blutbild
Wie kommt es denn eigentlich zu einer Sepsis ?
Häufigste Ursache der Sepsis sind Pneumonien mit 46,6 % der Fälle, gefolgt von intrabdominellen Infektionen in 28,7 % und urogenitale Infektionen in 12,6 % der Fälle. Weichteilinfektionen machen 10,4 % der Fälle aus. (Götze J, 2019)
Leider ist es immer noch so, dass nur in ca. 80 % der Fälle Blutkulturen entnommen werden. Allerdings ergibt sich auch nur in 30 % der Fälle ein positiver Befund, was evtl. auch auf eine falsche Entnahmetechnik oder auf eine zu geringe Zahl an Blutkulturen zurückzuführen ist.
Bei den positiven Fällen sind bei 55 % grampositive Erreger nachzuweisen, hier sind die häufigsten Staphylococcus aureus, koagulasenegative Staphylokokken und Enterokokken.
Im gramnegativen Keimspektrum zeigen sich v.a. E. coli, Pseudomonas aeruginosa, Klebsiellen, Enterobacter etc. , mit anderen Worten ein bunt gemischtes Keimspektrum.
Bei Pneumonien meist Streptococcus pneumoniae (grampositiv!). Seltener auch Haemophilus influenzae, Mykoplasmen, Pseudomonas oder Enterobakterien.
Viren können ebenfalls Septitiden auslösen (Influenza A+B, RSV).
Gibt es Risikogruppen für die Entwicklung einer Sepsis?
Natürlich, wie es immer so ist ! Risikogruppen sind immunsupprimierte Patienten (Chemotherapie, Z.n. Transplantation, Pat. mit Autoimmunerkrankungen (Rheuma!)). Aber auch Patienten mit Niereninsuffizienz, COPD, Leberzirrhose oder Diabetes.
Des weiteren sind schlechter Ernährungszustand, männliches Geschlecht und hohes oder sehr niedriges Alter häufiger betroffen.
Aber wie erkenne ich denn jetzt eine Sepsis?
Das Wichtigste vorab! Man muss erstmal daran denken, dass es überhaupt eine Sepsis sein könnte!
Eine Sepsis ist ein zeitkritischer Notfall! Genau wie ein akuter Myokardinfarkt oder ein Stroke!
Hierzu sei zu aller Erst auf Screeningtools wie auf den qSOFA oder den NEWS-Score verwiesen, wir bevorzugen den NEWS-Score. Aber besser irgendein Screening-Score als gar keinen !
Ist der Score positiv, dann auch schauen ob man eine Ursache findet !
Atemnot ? Husten ? – V.a. Pneumogenen Fokus
Dysurie ? – V.a. auf urogenitalen Fokus
Abdominelle Schmerzen ? Abwehrspannung ? -> V.a. abdominellen Fokus
Vigilanzminderung ? Meningismus.? -> V.a. ZNS-Fokus
Häufig übersehen werden Haut und Gelenke ! Gerade die Haut als Fokus eines Erysipels oder viel schlimmer noch einer nekrotisierenden Fasziitis werden gerne übersehen, gerade bei Diabetikern und generell immunsupprimierten Patienten sollte der Haut besondere Beachtung geschenkt werden.
Überwärmte, stark geschwollene Gelenke oder Schmerzen in der Wirbelsäule müssen nicht zwingend ein akuter Rheumaschub sein oder die übliche Lumbago. Nein, es kann auch ein septischer Fokus dahinter stecken !
Wie sieht ein richtig schlechter Patient aus ?
Schon mal was von „Mottling“ gehört ? Ein toller denglischer Begriff für Marmorierung !
Die Kollegen von Nerdfallmedizin haben hierzu ein tolles Video gemacht ! Auch die YoungEM Austria hat eine gute Zusammenfassung.
Im Prinzip geht es um Marmorierung als Zeichen von Minderdurchblutung bei schlechter peripherer Perfusion. Diese breitet sich von den Beinen aus, es lohnt sich also einmal auf die Beine zu schauen!
Und so schaut das aus!
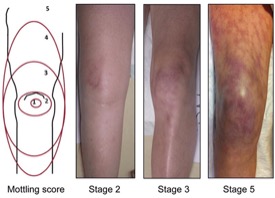
Quelle: https://emcrit.org/ibcc/shock/
Mottling hat keine hohe Spezifität, aber seht ihr das, dann hat der Patient ein Problem!
Genauso ist es mit der Atemfrequenz und dem Blutdruck. Deshalb werden diese Parameter auch in den gängigen Screening-Scores abgebildet.
Hierauf achten und wenn man in der Präklinik tätig ist, solche Patienten auch vor anmelden!
Und noch ganz wichtig: Die Körpertemperatur ist kein zuverlässiger Parameter für den Ausschluss einer Sepsis, auch ohne Fieber kann eine Sepsis vorliegen!
Aber was tun wir denn jetzt mit dem Patienten ?
Es kommt immer ganz auf den Tätigkeitsbereich an.
In der Präklinik gilt erstmal daran denken und den Patienten entsprechend in der ZNA voranmelden!
Dann 2 große Zugänge und Volumentherapie mit Vollelektrolytlösung. Das heißt jetzt bitte nicht 3 Liter Volumen bis zur Ankunft in der Klinik, aber 1000 ml VEL darf man dem Patienten schon gönnen.
Und natürlich bekommt der Patient ein Monitoring, das sollte klar sein.
Wie geht es in der Klinik weiter?
Auch hier gilt, zu allererst, dran denken und erkennen! Optimal wäre es wenn die Patienten in der Triage gescored werden würden, aber das bleibt leider aktuell flächenhaft noch Wunschdenken.
Die Surviving-Sepsis-Campaign hat ein 1-hour bundle zusammengestellt, welches auch in der aktuellen S3-Leitlinie wieder bestätigt wird:
- Blutkulturen abnehmen (mind. 2 Paar; Wir hätten gerne sogar 3!) vor Beginn der antiinfektiven Therapie
- Laktat messen und ggf. wiederholen wenn initiales Laktat > 2 mmol/l
- Breitspektrumantibiotika verabreichen
- Bei Hypotonie oder Laktat > 4 mmol/l Volumengabe einer Vollelektrolytlösung (kein NaCl!) mit Volumenbolus von 30 ml/kg KG
- Bei persistierender Hypotonie unter der oben genannten Volumentherapie Katecholamintherapie mit Ziel eines mittleren arteriellen Blutdruckes > 65 mmHG
Aus unserer Sicht gibt es immer wieder Defizite bei der Asservierung der Blutkulturen sowie bei der zeitgerechten Einleitung der antiinfektiven Therapie. Dabei ist es so, dass jede Stunde Verzögerung der kalkulierten antiinfektiven Therapie einen Mortalitätsanstieg von ca. 2 % bedingt. (Bloos F, 2017).
Bei V.a einen bestimmten Sepsis-Fokus kommt zur initialen Diagnostik selbstverständlich noch eine Bildgebung wie Sonographie, Röntgen oder auch CT hinzu. Hierdurch darf die Therapie allerdings nicht verzögert werden.
Weiteres zentrales Therapieziel muss dann selbstverständlich die Fokussanierung sein, so es denn möglich ist. Dies gilt insbesondere für Katheterassoziierte Septitiden, diese müssen entfernt werden. Allerdings sollten hier vor der Entfernung, wenn möglich, über den Katheter ebenfalls Blutkulturen abgenommen werden. Um die Differential time to positivity zu beurteilen und zu identifizieren ob der Fokus wirklich der Katheter war.
Antibiotikatherapie? Ja klar! Aber wie ?
Alle reden immer von kalkulierter antiinfektiver Therapie, wir ja auch. Aber womit denn überhaupt ?
Über fast kein Thema wird so wunderbar gestritten wie über dieses und eins muss man gleich vorweg nehmen. Es gibt nicht DIE kalkulierte Therapie. Die Therapie muss immer individuell erfolgen.
Hilfreich können hier die Tarragona-Kriterien sein, die als Entscheidungshilfe dienen. (Sandiumenge A, 2003).
| Tarragona-Prinzip | Erläuterung |
| Look at your patient | Fokusverdacht? Vortherapie ? Risikofaktoren? |
| Listen to your hospital | Resistenzlage, Keimspektrum? |
| Hit hard and early | In der ersten Stunden, hochdosiert & breites Spektrum |
| Get to the point | Hoher Wirkspiegel am Infektionsort |
| Focus, Focus, Focus | Kurze Therapiedauer, Deeskalation |
Die kalkulierte Therapie der Sepsis wird von der Paul-Ehrlich-Gesellschaft als Kombinationstherapie empfohlen (Bodmann K-F, 2018), spannend ist nun, dass die aktuelle S3-Leitlinie Sepsis hiervon abweicht und KEINE initiale Kombinationstherapie mehr empfiehlt (Brunkhorst FM, 2020). Dies könnte, nach unserer Interpretation, den Rote Hand-Briefen bzgl. der Fluorchinolone geschuldet sein.
Die S3-Leitlinie definiert aber auch Ausnahmen, also Fälle, bei denen immer noch eine initiale antiinfektive Therapie empfohlen wird. Dies gilt u.a. für die ambulant erworbene Pneumonie , Endokarditis oder ZNS-Infektionen. Zusammenfassend also Infektionen wo andere Leitlinien nach wie vor eine Kombinationstherapie empfehlen, ob sich dies in Zukunft ändert, wenn die entsprechenden Leitlinien überarbeitet werden, bleibt abzuwarten.
Analog zur neuen Leitlinie empfehlen wir zur kalkulierten Therapie bei unbekanntem Infektionsherd nun:
- Piperacillin/Tazobactam
Bei V.a. auf Pneumonie als Fokus:
- Piperacillin/Tazobactam + Erythromycin oder Clarithromycin
Die Dosierung sollte, unabhängig von eventuell vorliegender Nieren- oder Leberinsuffizienz, initial hochdosiert erfolgen. Im Verlauf kann die Dosis dann reduziert werden. Es ist von immenser Wichtigkeit einen ausreichend hohen Wirkspiegel in den Zielorganen zu erreichen!
Gelingt der Keimnachweis über die Blutkulturen oder andere Wege (Abstriche, Trachealsekret etc.) dann ist die antiinfektive Therapie anzupassen bzw. zu deeskalieren.
Und wie schaut es mit den Laborwerten aus?
Laborwerte sind auch immer ein leidiges Thema. Es gibt nicht DEN Sepsis-Marker im Labor.
Natürlich sind Leukozyten-Werte ein Marker für Entzündungsaktivität und damit ggf. auch für eine Sepsis. Ähnlich verhält es sich mit CRP und Procalcitonin (PCT), aber die Therapie hängt ja nicht alleine davon ab, sondern vom klinischen Zustand des Patienten.
Das Laktat ist ein Wert, auf den in der Sepsis-Therapie immer viel wert gelegt wurde, wie gut dieser wirklich ist, ist aktuell Gegenstand der wissenschaftlichen Diskussion. Aber warum legt man so viel Wert auf das Laktat? Ganz einfach, das Laktat ist ein Marker für Gewebe-Hypoxie, steigt es an, so kann man davon ausgehen, dass in der Peripherie Zellen mit Sauerstoff unterversorgt sind, weil dort einfach nicht genug Blut ankommt (ganz grob vereinfacht).
Also verwendet man das Laktat als Marker um hiermit die Therapie zu steuern. Daher findet auch das Laktat in der neuen S3-Leitlinie wieder Einzug in der Definition des septischen Schocks (MAP >65 mmHG nur mit Vasopressoren zu erreichen + Laktat > 2 mmol/l).
Ziel ist es, das Volumen so zu steuern, dass ein normaler Laktatwert erreicht wird.
Aber das PCT liegt auch immer besonders am Herzen, denn, damit kann man sehr schön die antiinfektive Therapie steuern.
Wir empfehlen am Beginn der Therapie das PCT täglich zu kontrollieren, fällt das PCT 2-3 Tage nach Therapiebeginn ab, so ist von einer richtigen antiinfektiven Therapie auszugehen. Danach sollte das PCT jeden zweiten Tag kontrolliert werden, fällt der PCT-Wert um 80 % des Maximalwerts oder auf einen Wert unter 0,5 µg/l, so kann die antiinfektive Therapie beendet werden. Dies wird auch in der aktuellen Leitlinie empfohlen.
Infusionstherapie! Aber wie?
Nach initialem Flüssigkeitsbolus ist die Volumentherapie mit Augenmaß durchzuführen. Wonach man das Ganze steurn sollte, da scheiden sich die Geister.
Manche meinen nach Laktat, manchen meinen nach PICCO, andere wieder nach ZVD.
Wir verfolgen einen etwas praktischeren Ansatz und orientieren uns erstmal am Patienten.
Wie ist die Herzfrequenz? Wie schaut es mit der Diurese aus? Können wir die Vasopressoren reduzieren?
Dazu bekommt jeder Patient im septischen Schock mindestens einmal täglich eine fokussierte Echokardiographie und eine Sonographie der V. Cava inferior (VCI) zur Beurteilung des Volumenstatus. Normalerweise hat die VCI einen Durchmesser von 15-20 mm beim spontan atmenden Patienten unter Ausatmung, bei Einatmung variiert dieser Wert um bis zu 50 %.
Ist die Atemvariabilität höher oder ist der Durchmesser deutlich kleiner, so spricht dies für einen Volumenmangel und der Patient kann doch noch etwas Volumen vertragen. PICCO und Co sehen wir als Ergänzung an. Ein passive leg-raise-Test kann ebenfalls zur Anwendung kommen, wie der geht, haben wir euch schon mal in dieser Folge erklärt.
Die Leitlinie bleibt bzgl. des Monitoring undeutlich, empfohlen wird aber eine initiale fokusierte Echokardiographie.
Wenn es um die richtige Infusionslösung geht, dann möchten wir noch einmal darauf hinweisen, dass NaCl 0,9 % nur für Nudeln ist und nicht für die Volumentherapie geeignet ist!
HAES hat auch in der Sepsis-Therapie nichts mehr zu suchen!
Bleiben also Balancierte Vollelektrolytlösungen übrig (Ringer-Acetat, Jonosteril, whatever), nur diese sollten verwendet werden! Reichen diese nicht aus, dann nutzt man als Vasopressor Noradrenalin. Ggf. kann man noch über Humanalbumin als HAES-Ersatz nachdenken, aber dieses sollte eine ultima ratio sein und nicht routinemäßig eingesetzt werden.
WICHTIG: Ist das Volumendefizit ausgeglichen, dann sollte das Volumen reduziert werden, eine Volumenüberladung ist zu vermeiden, da sie das Outcome verschlechtert!
Hierzu ist die tägliche Re-Evaluation erforderlich!
Und die Katecholamine?
Die neue Leitlinie empfiehlt Noradrenalin als Katecholamin der Wahl. Dobutamin kann, unter Berücksichtigung der pro-arrhythmogenen Nebenwirkungen erwägen, allerdings nur wenn von einem Ionotropie-Problem ausgegangen wird.
Für Dopamin gibt es keine Indikation mehr! Auch keine Nierendosis!
Kann man noch etwas tun?
Ja, kann man tatsächlich, aber die Evidenzlage ist dünn.
Immer wieder wird die Gabe von Kortikosteroiden diskutiert. In der neuen Leitlinie findet sich eine schwache Empfehlung mit niedrigem Evidenzgrad zur Gabe von Hydrocortison wenn sich unter adäquater Volumentherapie und hohen Katecholamin-Dosen keine Stabilisierung erreichen lässt.
Empfohlen wird eine intravenöse Dosis von 200 mg pro Tag. Dies deckt sich auch mit den internationalen Empfehlungen und wird von uns mit teilweise gutem Erfolg durchgeführt (Evidenzklasse E 😉 ).
Des weiteren geht es immer um die Vitamine, konkret um Thiamin (Vitamin B1) und Vitamin C. Die Diskussion wird kontrovers geführt, aber es gelang nachzuweisen, dass bei vielen Patienten im Septischen Schock ein Thiaminmangel vorliegt und dass die Thiamin-Gabe das Überleben verbessert. (Donnino MW, 2016). In die aktuelle Leitlinie fand dies keinen Eingang. Wir selber haben eine Zeitlang die Supplementierung durchgeführt, allerdings ohne messbaren Erfolg. Hier bleibt spannend, ob es weitere Studien geben wird, die diesen Erfolg aus der oben zitierten Studie wiederholen können.
Für Vitamin C existiert eine Studie die einen Vorteil für die kombinierte Therapie mit Hydrokortison, Thiamin und Vitamin C belegen konnte (Marik PE, 2017).
Das Therapieschema bestand aus Hydrokortison 4×50 mg/d + Thiamin 2 x 200 mg/d + Vitamin C 1,5 g alle 6 h. Hier gab es eine hoch signifikante Sterblichkeitsreduktion. Allerdings existiert eine große Meta-Analyse, die keinen Mortalitätsvorteil für den oben genannten Cocktail zeigt (Putzu A, 2019). Weitere Analysen bleiben abzuwarten, als Ultima ratio kann man es aber immer noch versuchen.

Punchlines:
- An Sepsis denken
- Sepsis ist ein zeitkritischer Notfall
- Blutkulturen asservieren und dann Antiinfektive Therapie beginnen
- Fluid-Resuscitation (30 ml/kg KG)
- Tarragona-Kriterien
- Am Anfang tägliche PCT-Kontrolle, dann alle 2 Tage
- Volumenstatus täglich evaluieren und Therapie anpassen
- Ggf. Hydrokortison + Thiamin + Vitamin C
Und hier noch unseren Flowchart zum Sepsis-Therapie zum Ausdrucken:
Den ganzen Artikel als PDF zum Ausdrucken findet ihr hier
Literaturverzeichnis
Bloos F, e. a. (2017). Effect of a multifacedet educational intervention for anti-infectious measurer on sepsis mortality: a cluster randomized trial. Intensive Care Med, S. 1602 – 1612.
Bodmann K-F, e. a. (2018). S2k-Leitlinie: Kalkulierte Initialtherapie bakterieller Erkrankungen bei Erwachsenen. AWMF Registernummer 082-006.
Brunkhorst FM, e. a. (2020). S3-Leitlinie Sepsis – Prävention, Diagnose, Therapie und Nachsorge. AWMF-Registernummer: 079 – 001.
Donnino MW, e. a. (44 2016). Randomized, double-blind, placebo-controlled trial of thiamine as a metabolic resuscitator in septic shock: a pilot study. Crit Care Med, S. 360-367.
Götze J, e. a. (April 2019). Infektiologische Notfälle – Fokus Sepsis. Notfallmedizin up2date, S. 209-223.
Marik PE, e. a. (2017). Hydrocortisone, Vitamin C, and thiamine for the treatment of severe sepsis and septic shock: a retrospective before-after study. Chest, S. 1229-1238.
Putzu A, e. a. (June 2019). The Effect of Vitamin C on Clinical Outcome in Critically Ill Patients: A Systematic Review With Meta-Analysis of Randomized Controlled Trials. Crit Care Med, S. 774 – 783.
Sandiumenge A, e. a. (2003). Therapy of ventilator-associated pneumonia. A patient-based approach based on the ten rules of „The Tarragona strategy“. Intensive Care Med, S. 876 – 883.

Pingback: Podcast Februar 2020 - Folge 13 - pin-up-docs - don't panic
Pingback: "titriert" Sepsis-Update 2020 - pin-up-docs - don't panic
Hallo mal wieder Ihr beiden,
erstmal großes Lob dass Ihr euch diesem schwierigem Thema „Sepsis“ gewidmet habt – schwierig deshalb weil es, wie ihr selbst ja bereits gesagt hab, nicht wenig an Kontroversen und Unklarheiten diesbezüglich gibt. Am allermeisten drehen sich diese Kontroversen gefühlt sogar um die nicht-antibiotische Therapie, also Vasopressoren/Flüssigkeit/Therapiesteuerung/additive Therapie mit Hydrokortison/Vitamin C/Thiamin etc.
Ich habe lange überlegt ob ich ein Kommentar schreiben soll oder nicht, schlussendlich dachte ich mir aber dass eine Plattform wie diese aber ja genau dafür gedacht ist. Dinge könnten und sollten diskutiert werden, insbesondere wenn es unterschiedliche Standpunkte zu einer Sache gibt ohne dass ausreichend Evidenz für den einen oder anderen Standpunkt vorliegt.
Genau wie Johannes getriggert wird wenn er von einer halben Dosis Antibiotikum bei der initialen Sepsis-Therapie aufgrund einer bestehenden Niereninsuffizienz hört 😉 so hat mich der Satz:
„Ziel ist es, das Volumen so zu steuern, dass ein normaler Laktatwert erreicht wird.“
aufhorchen lassen. In der FOAM-Welt gibt es zum dem Thema Laktat und insbesondere Laktat in der Sepsis so einiges zu lesen so dass ich dies nicht unkommentiert lassen wollte.
Zunächst mal: Ich habe ebenfalls seit dem Studium gelernt und eingetrichtert bekommen dass Laktat ein Marker für Gewebshypoxie ist (vereinfacht gesagt). Punkt. So einfach, so praktisch. Im septischen Schock ist das Laktat ja quasi immer hoch (weswegen es ja auch Teil der Definition dessen ist). Also: wenn Laktat hoch dann musst du was für die Perfusion tun. Punkt. Bei mir, und ich schätze auch beieinem großen Anteil der tätigen Ärzteschaft hat das zu dem antrainiertem Dauerreflex geführt: Laktat hoch ==> Volumen rein. Laktat immernoch hoch ==> noch mehr Volumen rein. Ich weiß nicht wie oft ich diese Argumentation und Vorgehensweise, vom Chef – und Oberarzt bis zur/zum Intensivpflegepraktikantin/-en im klinischen Alltag gehört habe aber es kommt mir vor wie ein Dauer-Ohrwurm.
Um es kurz zu machen: Es scheint bewährte, klinische Praxis zu sein.
Ich weiß auch dass die Leitlinie dieses Vorgehen durchaus propagiert, genauso wie es einen Volumenbolus von 30ml/Kg KG empfiehlt. Diese Zahl hält sich übrigens seit Jahren hartnäckig, trotz eines echt schwachen „Evidenzgrad niedrig“. Interessanterweise hat die Deutsche Leitlinie von 2020 den Empfehlungsgrad auf „schwach“ zurückgestuft, ist mir beim Schreiben des Kommentars zufällig aufgefallen.
https://www.awmf.org/uploads/tx_szleitlinien/079-001k_S3_Sepsis-Praevention-Diagnose-Therapie-Nachsorge_2020-02.pdf
Nun seid ihr in eurem Artikel ja schon ausreichend auf andere Methoden eingegangen um den Flüssigkeitsstatus des Patienten zu evaluieren (passive-leg-raise, POKUS etc.). Allerdings könnte man auch hier anmerken dass der Großteil dieser Methoden darauf abzielt zu evaluieren ob eine „Volumenreagibilität“ vorliegt. Nun ist es fraglich ob die Tatsache dass ein Patient mit mehr Volumen „mehr anfangen kann“, also sprich durch mehr Flüssigkeitszufuhr das HVZ noch steigerbar ist, automatisch bedeuten muss dass man diese Flüssigkeit auch zwingend verabreichen muss. Das ist aber eigentlich ein anderes Thema und würde an dieser Stelle zu weit führen.
Wenn man sich jetzt aber mit Laktat und dessen Physiologie näher auseinandersetzt wird einem schnell klar dass in den letztlich gemessenen Laktatspiegel noch einiges mehr an Variablen miteinfließt (Clearance über Leber, Medikamente, Thiamin etc.).
Insbesondere gibt es einen Entstehungsmechanismus der so rein garnix mit anaerober Glykolyse und Gewebshypoxie zu tun hat. Ganz kurz zusammengefasst lässt sich das so beschreiben: Sepsis führt zu einer Stressreaktion des Körpers mit Freisetzung endogener Katecholamine, insbesondere Epinephrin. Dies führt über eine Kaskade zu einer erhöhten Glucosefreisetzung, was wiederum zu erhöhten Pyruvatspiegeln führt, welches nicht in gleichem Maße in den Zitratzyklus überführt werden kann. Das „überschüssige“ Pyruvat wird dann schließlich zu Laktat umgewandelt. Ein Vorgang der erstmal nichts mit Gewebshypoxie zu tun hat. Eine kleine Graphik zur Veranschaulichung:
https://1.bp.blogspot.com/-QQbnmhBIgRg/VZnUjry0o-I/AAAAAAAABfQ/tKBcVuByGa4/s1600/lactatemetabolism.gif
Dies entspricht übrigens dem gleichen Mechanismus der unter einer Epinephrin-Therapie prinzipiell zu erhöhten Laktatspiegeln führt. Ein Effekt welchen wahrscheinlich jeder Intensivmediziner schonmal beobachtet hat, und hier macht sich normalerweise niemand um eine etwaige Gewebshypoxie Gedanken da es ja klar ist dass das Laktat auf den Epinephrin-Effekt zurückzuführen ist.
Hier mal zwei Papers dazu:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6334727/
https://ccforum.biomedcentral.com/articles/10.1186/s13054-014-0503-3
Im Kontext der Sepsis wird also zunehmend in Frage gestellt ob der Mechanismus der Gewebshypoxie für den Laktatspiegel überhaupt relevant ist oder ob dieser nicht vielmehr Zeichen für das Ausmaß der endogenen Epinephrin-Freisetzung ist. (Welche typischerweise von Patient zu Patient auch sehr verschieden sein kann, je nach Konstitution, Alter etc.)
Die Flüssigkeitstherapie daran zu orientieren dass dadurch normale Laktatspiegel erreicht werden, scheint vor diesem Hintergrund eigentlich völlig unlogisch und ist eher mit einem nicht zu unterschätzendem Risiko einer iatrogenen Schädigung durch Hypervolämie, Ödemen etc. assoziiert.
Ich zitiere an dieser Stelle einen recht bekannten Intensivmediziner der FOAM-Szene:
If you’re making clinical decisions on the basis of tiny deviations in lactate level, then you’re using the lactate lab value wrong.
Wichtig ist es an dieser Stelle zu betonen:
– Ein erhöhtes Laktat ist natürlich immer ein Marker dafür dass mit dem Patienten etwas ernsthaft nicht in Ordnung ist und ist nachweislich mit erhöhter Mortalität assoziiert. Nur sollte dies nicht mit einem unreflektiertem Kristalloid-Flooding-Reflex beantwortet werden sondern eher zu einer gewissenhaften, gründlichen Untersuchung des Patienten führen. „Sich den Patienten mal genau anschauen“.
– Es gibt Patienten man anhand ihrer Vitalparameter und ggf. auch nach ihrer „Klinik“ zunächst mal als nicht-kritisch einstufen würde. Ein erhöhter Laktat-Spiegel kann hier Anlass geben diese Patienten nicht auf die leichte Schulter zu nehmen. Stichwort „occult shock“
– Es gibt Patienten die sehr wohl kritisch krank sind obwohl sie keine erhöhten Laktatspiegel aufweisen. Dies könnten Patienten mit inadäquater Sympathikusreaktion sein, z.B. alte, betagte Menschen, Langzeitintensivpatienten(?)
– Die Ausführungen oben sollen auch nicht heißen dass der Gewebshypoxie-Mechanismus nicht existent ist, Beispiele hierführ könnten z.B. sein: ein Patient mit kaltem, ischämischem Bein, Patient mit Z.n. Reanimation, Patient mit schwerem kardiogenem Schock. (Den Mechanismus der Laktatentstehung bei den beiden letzten Beispielen könnte man dabei auch durchaus als „gemischt“ interpretieren!)
Hier noch ein paar Links, zugegebenermaßen etwas einseitig der Herkunft betreffend, von dort aus kann man sich aber nach Lust und Laune weiterklicken…
https://emcrit.org/pulmcrit/understanding-lactate-in-sepsis-using-it-to-our-advantage/
https://emcrit.org/isepsis/isepsis-lactate-myths/
https://emcrit.org/emcrit/lactate/
https://emcrit.org/wp-content/uploads/lactate-faq.pdf
ein sehr spannendes Thema wie ich finde! Und eines welches einem eigentlich ständig im Alltag begegnet!
Hallo Philipp,
vielen Dank für deinen ausführlichen und spannenden Kommentar!
Wir haben in unserer Folge tatsächlich Laktat als Marker für eine effiziente Sepsis-Therapie nur kurz anklingen lassen und nur nebenbei erwähnt, dass da einiges „im Fluss“ ist. Daher ist dein Kommentar super wichtig !
Ich halte auch wenig davon, jeden Patienten unreflektiert mit Volumen zu fluten, auch wenn die Leitlinie es primär so empfiehlt. Deshalb solle der septische Patient einmal pro Schicht bezüglich des Volumenstatus evaluiert werden. Ich bevorzuge hierfür POCUS, andere Kliniken mögen das anders Hand haben. Das ist von Haus zu Haus sehr unterschiedlich.
Worauf man sich am ehesten einigen kann, ist wahrscheinlich, dass man den Patienten als Ganzes betrachten muss (Diurese, Labor, Vitalwerte, Eyeballing etc.) und davon abhängig die Volumentherapie steuert.
Wir werden im Anfangsteil der nächsten Folge noch einmal ausführlicher auf die kontroverse Diskussion eingehen.
Viele Grüße von den Pin-Up-Docs,
Johannes
Vielen Dank für diesen Beitrag zum Thema Sepsis. Gut zu wissen, dass Sepsis eine Vielzahl von Organen angreift. Ich werde mal einen Sepsis Test machen lassen.
Hallo,
unsere Artikel sind vor allem an medizinisches Fachpersonal adressiert und sollen explizit nicht für Eigendiagnosen verwendet werden. Einen „Sepsis Test“ an sich gibt es nicht.. Es gibt nur einzelne Faktoren, die für oder gegen eine Sepsis sprechen und immer in Zusammenschau aller Befunde gesehen werden sollten. Sollten Sie Beschwerden haben, wenden Sie sich bitte an ihren behandelnden Arzt oder ihre behandelnde Ärztin.
Mit freundlichen Grüßen
ihre Pin-up-docs