Postpunktioneller Kopfschmerz – PDPH (post dural puncture headache)

Ich als Ärztin in der Anästhesie kenne vor allem den post-punktionellen Kopfschmerz, allerdings kann der selbe Kopfschmerz natürlich auch idiopathisch durch spontane Liquorlecks oder durch spinale Liquorfisteln entstehen.
Eines haben diese Art Kopfschmerzen aber in der Regel gemeinsam: Ein Liquorunterdruck-Syndrom (LUS).
Wann tritt ein PDPH auf?
- Nach einer diagnostischen Liquorpunktion
- Nach der Anlage eines Periduralkatheters (= PDK) mit versehentlicher Durapunktion
- Nach einer Spinalanästhesie
- Idiopathisch bei spontanem Liquorleck oder bei Liquorfistel
Pathophysiologie
Die genaue Pathophysiologie ist noch unklar, es scheint aber wie in der Einführung schon gesagt mit einem Liquorunterdruck assoziiert zu sein. Wichtig ist aber zu wissen, dass nicht alle Patient*innen mit PDPH einen niedrigen Liquordruck haben und auch nicht alle Patient*innen mit einem signifikanten Liquorleck Kopfschmerzen entwickeln.
Es werden unterschiedliche Pathomechanismen diskutiert:
- Annahme 1: Durch das Liquorleck kommt es zu einer kompensatorischen Venodilatation und Blutvolumenexpansion, wobei die Kopfschmerzen durch die Dehnung der Venen (venöse Distension) entstehen. Dazu passen auch die bisherigen MRT-Befunde Hannerz et al. / Bakshi et al
- Annahme 2: Durch eine intrakranielle Hypotonie im Zusammenhang mit einem Liquorleck kann es zu einer Erschlaffung der intrakraniellen Strukturen und einer Dehnung der sensorischen Hirnnerven kommen, hieraus, – so die Annahme, – ergeben sich Schmerzen und Hirnnervenlähmungen. In einer Studie mit sieben Patient*innen mit intrakranieller Hypotonie wurde im MRT eine „Abwärtsverschiebung“ des Gehirns festgestellt, die mit Kopfschmerzen einherging und zusammen mit den Kopfschmerzsymptomen verschwand. Zudem kann eine Traktion der oberen Halsnerven mit einer PDPH assoziiert sein. Panullo et al. / Ljubisavljevic et al
- Annahme 3: Nach einer Lumbalpunktion kommt es zu einer erhöhten kaudalen Compliance am lumbalen Ende des spinalen Liquorraums, was zu einer zusätzlichen intrakraniellen Hypotonie und venösen Dilatation in aufrechter Position führen kann. So lässt sich sowohl der orthostatische Kopfschmerz erklären als auch, dass spinale, aber nicht kraniale Leckstellen orthostatische Kopfschmerzen verursachen. Das weitgehende Fehlen von PDPH bei sehr jungen und älteren Menschen erklären sich die Autor*innen mit der relativen Steifheit des Epiduralraumes in diesen Altersgruppen. Levine et al.
Exkurs: Monroe-Kellie-Doktrin
Wenn man sich mit Veränderungen der Volumenverhältnisse im Kopf beschäftigt, ist es immer gut manche physiologischen Überlegungen zu kennen, so auch die Hypothese der Monroe-Kellie-Doktrin, die besagt, dass die Summe der drei intrakraniellen Volumenkomponenten (Hirngewebe, Liquor cerebrospinalis und Blut) immer gleich bleiben muss, um den Hirndruck auf einem konstanten Niveau zu halten. Somit führt die Volumenzunahme einer dieser drei Komponenten zur gleichförmigen Abnahme einer oder der beiden anderen Komponenten.

Inzidenz und Risikofaktoren
Nach Spinalanästhesie kommt es normalerweise in < 3 % zu einem PDPH, diese Zahl kann aber durch Risikofaktoren für das Auftreten eines PDPH individuell bis auf eine Zahl von 9 % erhöht sein.
Nach einer diagnostischen Lumbalpunktion, liegen die Zahlen bei circa 11 %.
Welche Risikofaktoren sind für das Auftreten eines post-punktionellen Kopfschmerzes bisher beschrieben bzw. diskutiert wurden:
- Weibliches Geschlecht
- Bestehende Schwangerschaft
- Vorbeschriebene Kopfschmerzen (entweder schon mal PDPH oder auch chronische Kopfschmerzen)
- Eine Altersspanne zwischen 18-50 Jahre
- Bei Kindern ist die Inzidenz niedriger, was wohl an der größeren Elastizität der Dura im Kindes- und Jugendlichenalter liegt.
- Ein niedriger BMI
- Ein stark erhöhter BMI hat in der Regel auch mehr Anteil an epiduralem Fettgewebe, weshalb ein PDPH seltener auftritt.
- Möglicherweise ein niedriger Eröffnungsdruck bei Lumbalpunktionen.
- Möglicherweise auch das entnommene Liquor-Volumen bei Lumbalpunktionen.
Und natürlich gibt es nicht nur Patient*innen-seitig Risiken, sondern auch auf der „stumpfen Seite der Nadel“ – also bei unserem Handeln – können Unterschiede beschrieben werden:
- Die Spitze der Nadel kann einen Einfluss haben: Hier sind Spinalnadeln mit atraumatischer „Bleistift-Spitze“ (Whitacre- und Sprotte-Nadeln) anstatt Nadeln mit scharfen Spitzen (Quincke-Nadeln) risikoärmer.
- Die Größe der Nadel kann auch einen Einfluss haben: Größere Nadeln (also kleinere Gauge-Zahl) scheint das Auftreten von PDPH zu vermehren.
- Sofern eine scharfe bzw. schneidende Quincke-Nadel verwendet wird, spielt auch die Nadelausrichtung eine Rolle: So soll man die Quincke-Nadel mit dem Schliff parallel zur Längsachse der Wirbelsäule einführen.

(Ein Wiedereinführen des (Stahl-)Mandrins war wohl bisher in Studien nicht überlegen.)
Prävention
Eine medikamentöse Therapie kann in Einzelfällen sinnvoll sein, eine generelle Empfehlung zur medikamentösen Prophylaxe gibt es allerdings nicht.
- In einigen kleineren Studien zeigte sich eine niedrigere Inzidenz von PDPH bei der Gabe von epiduralem Morphin und intravenösem Cosyntropin nach versehentlicher Durapunktion in der geburtshilflichen Anästhesie.
- Ondansetron: Bei der Gabe von 0,15 mg/kgKG konnte bei einigen geburtshilflichen Anästhesien mit SPA (Spinalanästhesie) und der Verwendung von Quincke-Nadeln eine niedrigere Rate an PDPH als bei Patientinnen ohne Ondansetron gezeigt werden.
- Ein Bloodpatch kann auch prophylaktisch erwogen und theoretisch sogar über einen einliegenden PDK verabreicht werden. Hierbei scheint der Bloodpatch aber nicht das Auftreten eines PDPH zu verringern, sondern die Symptomstärke zu mindern. (Eine Möglichkeit der Anwendung ist, vor dem Entfernen des PDKs noch einen Bloodpatch über den einliegenden PDK zu machen.)
- Bei einer versehentlichen Durapunktion während einer geburtshilflichen PDK-Anlage, kann das Legen eines intrathekalen Katheters erwogen werden. ABER hier ist besondere Vorsicht geboten, da diese UNBEDINGT KLAR gekennzeichnet werden müssen und keinesfalls mit einem „normalen“ PDK verwechselt werden dürfen. Eine Analgesie ist auch über einen einliegenden intrathekalen Katheter möglich, dieser sollte aber nach der Entbindung frühzeitig entfernt werden. (Anmerkung: Auf dem DAC wurde sich dafür ausgesprochen, bei solchen Sonderfällen als Anästhesist*in nicht von der Seite der betroffenen Patientin zu weichen.) Zumal die prophylaktische Wirkung bisher nicht in randomisierten, kontrollierten Studien bewiesen werden konnte. Es gibt hierzu also keine generelle Empfehlung und die prophylaktische Wirkung für ein verringertes Auftreten eines PDPH ist sehr fragwürdig.
Ein paar Mythen, die nicht zur Prävention beitragen, sich aber wie immer laaaaaaange in den Köpfen der Mediziner*innen halten:
- Bettruhe: Verordnete Bettruhe zeigt keinen prophylaktischen Effekt gegen das Auftreten eines PDPH!
- Bauchbinden: Das Tragen einer Bauchbinde zeigt keine negativen Effekte, allerdings gibt es auch aufgrund der fehlenden Evidenz keine Empfehlung für das Tragen einer Bauchbinde um einen prophylaktischen Effekt gegen das Auftreten einer PDPH nach einer versehentlichen Durapunktion bei PDK-Anlage zu erreichen. (Der Effekt soll wohl darauf beruhen, dass durch den erhöhten intraabdominellen Druck sich auf den Periduralraum überträgt und somit den weiteren Liquoraustritt minimieren bzw. verhindern soll.)
- Orales Coffein: Zeigte keine prophylaktischen Effekte nach einer versehentlichen Durapunktion bei PDK-Anlage!
Symptome
Meist treten die Symptome spätestens nach 72 Stunden nach einer duralen Punktion auf, selten wurden auch von Fällen nach bis zu zwei Wochen berichtet.
- Frontale oder occipitale Kopfschmerzen, die sich durch aufrechtes Sitzen oder Stehen verschlechtern
- Übelkeit und/oder Erbrechen
- Nacken- und/oder Schultersteifigkeit
- Schmerzen im unteren Rücken
- Schwindel
- Sehstörungen wie Diplopie, verschwommenes Sehen oder Photophobie
- Tinnitus oder Hörminderung
Die meisten PDPH-Symptome verschwinden ohne Therapie innerhalb einer Woche.
Diagnose und Differenzialdiagnosen
PDPH ist eine Ausschlussdiagnose, vor allem bei atypischen Symptomen müssen andere Ursachen ausgeschlossen werden. Eine generelle Bildgebung mittels CT oder MRT ist bei typischen Beschwerden nicht notwendig, allerdings dann indiziert, wenn andere Ursachen wie zum Beispiel eine cerebrale Sinusthrombose ausgeschlossen werden müssen.
Eine erneute diagnostische Lumbalpunktion sollte aufgrund der Gefahr des Aggravierens von Symptomen vermieden werden.
Differenzialdiagnostisch sollte man eine Hirnblutung, eine Thrombose, eine Vaskulopathie sowie eine Meningitis ausschließen. Vor allem, wenn eine Besserung durch einen durchgeführten Bloodpatch ausbleibt.
Als Koinzidenz können natürlich auch sämtliche anderen Formen von Kopfschmerzen auftreten, wie zum Beispiel Migräne und Spannungskopfschmerz.
Therapie
Nicht immer muss eine Therapie durchgeführt werden. Sofern die Patient*innen aufstehen und sich in aufrechter Position nur mit milden Symptomen bewegen können, kann gegebenenfalls und in enger Rücksprache mit den Patient*innen selbst auf eine Therapie verzichtet werden.
Bei milden Symptomen kann auf Bettruhe zu Milderung der Symptome hingewiesen werden, aber auch auf medikamentöse Therapie und ausreichende Flüssigkeitsaufnahme verwiesen werden.
Medikation:
- Coffein: Orale Gaben von Coffein wird häufig bei PDPH eingesetzt, allerdings ohne belastbare relevante Evidenz zu haben, dass Coffein wirklich wirkt (Halker et al.). Es gibt einzelne Hinweise, dass der Schmerzscore in den ersten Stunden nach Coffein-Gabe erniedrigt war, nach 24h fand sich aber kein signifikantes Ergebnis. Es zeigten sich aber auch keine signifikanten Komplikationen. Aber CAVE: Bei der intravenösen Gabe von Coffein wurden Grand Mal – Krampfanfälle beschrieben.
- Trotz der mangelhaften Evidenzlage bleibt Coffein in den aktuellen Empfehlungen zur Therapie noch enthalten.
- Analgetika:
- NSAR
- Paracetamol
- Kombinationsanalgetika: Butalbital-Acetaminophen-Coffein
- Weitere Medikamente – jeweils ohne signifikante Evidenz: Gabapentin, Hydrocortison, Theophyllin, Neostigmin/Atropin können die Symptomschwere mindern.
- KEIN Benefit zeigte sich bei Sumatriptan und adrenocorticotrope Hormone

Tabelle: Modifiziert u.a. mithilfe von Embryotox aus der Leitlinie „Diagnostik und Therapie des postpunktionellen
und spontanen Liquorunterdruck-Syndroms“ und dem Artikel aus „Die Anästhesiologie“ von Siegler et al.
Sofern diese Maßnahmen nicht ausreichen und Aktivitäten des alltäglichen Lebens nicht mehr möglich sind, sollte frühzeitig! ein Bloodpatch angeboten werden:
Bloodpatch:
Der Bloodpatch ist ein therapeutischer Ansatz, der in vielen Fällen zu schneller Besserung der Symptome führt. Die Erfolgsrate liegt zwischen 65-98%, mit ähnlicher Rate für eine zweite Bloodpatch-Therapie.
Durchführung:
Ein Bloodpatch ist eine Eigenblut-Injektion in den Epiduralraum der Patient*innen mittels einer periduralen Punktion.
- Die Patient*innen sollten während der Intervention an ein Basis-Monitoring angeschlossen sein und mit einem gut laufenden i.v. Zugang ausgestattet sein.
- Es empfiehlt sich eine 2-Personen Methode, bei der eine Person mittels einer periduralen Punktion den Epiduralraum aufsucht und eine zweite Person unter absolut sterilen Bedingungen Blut des Patienten/der Patientin abnimmt und dann steril zur Person die den Epiduralraum identifiziert hat, herüber gibt.
- Es sollten mindestens 20 ml Blut steril abgenommen werden, aber erst unmittelbar bevor der Epiduralraum durch die zweite Person aufgesucht wurde.
- Injektion von circa 20 ml Blut in den Periduralraum, wobei man aufhören sollte weiter Blut zu injizieren, wenn die Patientin/ der Patient über Schmerzen oder Druckgefühl im Rücken klagt. (In einer Übersichtsarbeit (Paech MJ, Doherty DA, Christmas T, et al. The volume of blood for epidural blood patch in obstetrics: a randomized, blinded clinical trial. Anesth Analg 2011; 113:126.), bei der 120 geburtshilflich aufgenommene Frauen mit PDPH entweder 15, 20 oder 30 ml epidural verabreicht bekommen haben, zeigte sich ein Blutvolumen von 20 ml einem Volumen von 15 ml überlegen, bei 30 ml zeigte sich aber kein weiterer positiver Effekt – auch nicht, dass man es ggf. nicht nochmals wiederholen musste.)
Der Mechanismus der hinter dieser Maßnahme steckt, ist bisher noch nicht vollständig erforscht, es scheint aber eine multifaktorielle Wirkung zu haben.
- Durch die Injektion von Blut wird zum einen der Duralsack komprimiert und so der Liquordruck relativ erhöht.
- Zum anderen wird auch diskutiert, dass die „Verletzung“ der Dura durch die Punktion durch das Blut mitunter durch eine inflammatorische Reaktion bzw. die Blutgerinnung verschlossen wird.
Zeitpunkt:
Es gibt keine klaren Regeln, wann man einen Bloodpatch anbieten sollte, es gab aber einige retrospektive Studien, die einen erhöhte Effektivität gezeigt haben, wenn der Bloodpatch 24-48 h nach der duralen Punktion durchgeführt wurde. Es sollte dadurch aber bei Symptomen keine Verzögerung des Bloodpatches erfolgen.
Höhe für den Bloodpatch:
Es wird gesagt, dass die selbe Höhe erneut punktiert werden soll, wo auch zuvor die Dura fraglich verletzt wurde. Sofern mehrere Höhen punktiert wurden, soll die kaudalste also niedrigste Höhe erneut auch für den Patch verwendet werden, da sich das Blut eher nach oben hin ausbreitet.
Worauf muss man achten? // Kontraindikationen
Blutgerinnung:
- Bei eingeschränkter Blutgerinnung, Koagulopathien oder Patient*innen unter Antikoagulation kann ein Bloodpatch kontraindiziert sein.
Infektionen:
- Eine systemische oder lokale Entzündung kann eine Kontraindikation darstellen!
- Bei einer bestehenden HIV-Infektion, kann das Risiko einer ZNS-Infektion bestehen.
Komplikationen:
- Rückenschmerzen kommen in 25-35% der Fälle nach einem Bloodpatch vor, die im Median circa 28 Tage anhielten (Abouleish E, Vega S, Blendinger I, Tio TO. Long-term follow-up of epidural blood patch. Anesth Analg 1975; 54:459. / Kalina P, Craigo P, Weingarten T. Intrathecal injection of epidural blood patch: a case report and review of the literature. Emerg Radiol 2004; 11:56. Desai MJ, Dave AP, Martin MB. Delayed radicular pain following two large volume epidural blood patches for post-lumbar puncture headache: a case report. Pain Physician 2010; 13:257.).
- Temperaturerhöhung
- Nervenwurzelreizung
- Seltene Komplikationen sind spinale Subduralhämatome, intrathekale Injektionen und Arachnoiditis, Infektionen inklusive subduralen Abszessen, faciale Nervenparalyse, spastische Paraparese und Cauda equina Syndrom.
Anmerkung:
Die Studie von Lee et al. zeigte deutlich, dass sowohl die Häufigkeit niedriger, als auch der Zeitpunkt eines Bloodpatches später bei „Racial and Ethnic Disparities“ gewählt wurde. Deshalb muss bei der Behandlung unbedingt darauf geachtet werden, dass – wie immer – unabhängig von Ethnie- und anderen Faktoren rein die Klinik das ist was zählt und wir alle Patient*innen gleich gut behandeln!!
Weitere Alternative therapeutische Methoden:
- Sofern eine Eigenblutinjektion nicht möglich ist, stellen die Applikation von epiduralem NaCl, Dextran oder eine CT-gesteuerte Applikation von Fibrinkleber Therapie-Alternativen dar.
- Bilaterale transnasale sphenopalatinum Blockaden
Video für alle, die gern holländische Sprache !? hören: https://player.vimeo.com/video/303243627
- Occipitale Nervenblockaden
Beide Methoden (Bilaterale transnasale sphenopalatinum Blockaden und auch occipitale Blockaden) sind bisher noch zu wenig erforscht und werden nicht grundsätzlich empfohlen.
Zur intranasalen Lidocain Applikation mittels MAD Device verweisen wir auf unseren Journal Club Beitrag im Juni 2021.
- Operativer neurochirurgischer Verschluss eines Liquorlecks
Den Durchblick verloren? .. Ein Algorithmus hilft ja bekanntlich immer ..
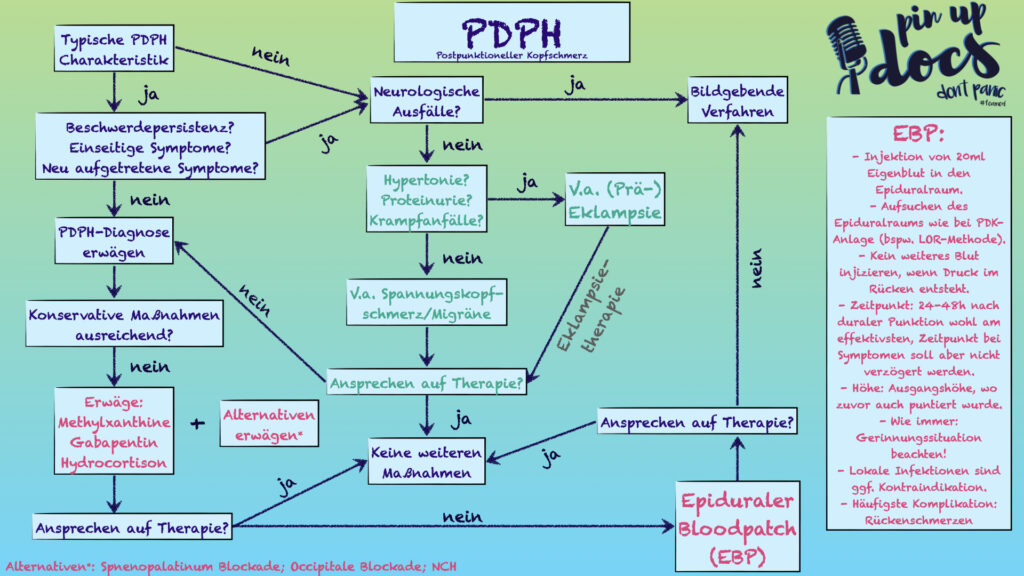
PDPH – Algorithmus, modifiziert nach: Siegler et al. doi: 10.1007/s00101-022-01171-2
Zusammenfassung:

- Postpunktionelle Kopfschmerzen sind vor allem bei bestehenden Risikofaktoren (Junge, schlanke Frauen, Kopfschmerzanamnese, Schwangerschaft, zuvor schon beschriebene post-funktionelle Kopfschmerzen) nicht so selten.
- Durch viel Übung bei der periduralen Punktion kann das Auftreten versehentlicher Dura-Perforationen minimiert werden
- Es müssen relevante schwerwiegende Differenzialdiagnosen ausgeschlossen werden (Differenzialdiagnosen: Cerebrale Sinusthrombose, Hirnblutung, eine Thrombose, eine Vaskulopathie, sowie eine Meningitis), deshalb muss im Zweifel eine bildgebende Diagnostik erfolgen.
- Typische Symptome sind: Frontale oder occipitale Kopfschmerzen, die sich durch aufrechtes Sitzen oder Stehen verschlechtern, Übelkeit und/oder Erbrechen, Nacken- und/oder Schultersteifigkeit und Schmerzen im unteren Rücken
- Therapie: Es sollte frühzeitig ein Bloodpatch angeboten werden.
- Medikamentös sind NSARs möglich und es kann Coffein erwogen werden. Die Evidenzlage für die Gabe von Coffein, NSAIDs und weitere Co-Analgetika wie Gabapentin oder Hydrocortison ist bisher unzureichend.
- Weitere therapeutische Optionen sind: Applikation von epiduralem NaCl, Dextran oder eine CT-gesteuerte Applikation von Fibrinkleber; Bilaterale transnasale sphenopalatinum Blockaden; occipitale Nervenblockaden und ein neurochirurgischer Verschluss des Liquorlecks. (Auch hier ist die Evidenzlage unzureichend.)
- Medikamentös sind NSARs möglich und es kann Coffein erwogen werden. Die Evidenzlage für die Gabe von Coffein, NSAIDs und weitere Co-Analgetika wie Gabapentin oder Hydrocortison ist bisher unzureichend.
- Wichtig ist vor allem ein „Follow-up“ und sich zu kümmern. (Informationsweitergabe an Station und weitere Behandelnde, Nennung in Brief an den Hausarzt)
Disclaimer
Der Inhalt sollte nicht als medizinischer Rat für Patient*innen verstanden werden. Obwohl wir alle Anstrengungen unternehmen, um sicherzustellen, dass die von uns geteilten Informationen korrekt sind, freuen wir uns über Kommentare, Vorschläge oder Korrekturen von Fehlern. Datenschutz ist für uns von größter Bedeutung. Zahlen und Quellen sollten stets überprüft werden. Medizin unterliegt einem ständigem Wandel. Es wird keine Garantie für die Richtigkeit und Aktualität von Aussagen, Dosierungen oder Meinungen gegeben.
Wie immer vielen Dank an das Pin-up-docs-Team für die vielen guten Anmerkungen und Verbesserungen!
Autorin:
Dr. med. Dana Maresa Spies
Quellen:
Alle oben genannten Quellen im Text, sowie:
https://www.uptodate.com/contents/post-dural-puncture-headache/print
https://www.pschyrembel.de/Monro-Kellie-Doktrin/K0PQB
https://www.nysora.com/de/Anästhesie/Kopfschmerz-nach-Duralpunktion/
Tubben RE, Jain S, Murphy PB. Epidural Blood Patch. 2022 Jul 4. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 29493961.
Amini N, Modir H, Omidvar S, Kia MK, Pazoki S, Harorani M, Moradzadeh R, Derakhshani M. The Effect of Sumatriptan, Theophylline, Pregabalin and Caffeine on Prevention of Headache Caused By Spinal Anaesthesia (PDPH): A Systematic Review. J West Afr Coll Surg. 2022 Oct-Dec;12(4):102-116. doi: 10.4103/jwas.jwas_183_22. Epub 2022 Nov 23. PMID: 36590776; PMCID: PMC9802600.
Li H, Wang Y, Oprea AD, Li J. Postdural Puncture Headache-Risks and Current Treatment. Curr Pain Headache Rep. 2022 Jun;26(6):441-452. doi: 10.1007/s11916-022-01041-x. Epub 2022 Mar 30. PMID: 35353358.
https://www.sciencedirect.com/science/article/abs/pii/S1521689622000039
Lee A, Guglielminotti J, Janvier AS, Li G, Landau R. Racial and Ethnic Disparities in the Management of Postdural Puncture Headache With Epidural Blood Patch for Obstetric Patients in New York State. JAMA Netw Open. 2022 Apr 1;5(4):e228520. doi: 10.1001/jamanetworkopen.2022.8520. PMID: 35446394; PMCID: PMC9024387.
