Akutmanagement – Status epilepticus

CAVE: Seit der Erstellung dieses Artikels wurden neue Leitlinien zur Therapie des Status Epilepticus veröffentlicht. Bitte lest auch die aktuellen Leitlinien:
https://www.awmf.org/leitlinien/detail/ll/030-079.html
Egal ob innerklinisch oder präklinisch, die meisten Krampfanfälle sind vorbei, wenn wir dazu kommen. Hin und wieder trifft man aber doch auf einen aktiv krampfenden Patienten.
Die deutschen Leitlinien zum Status epilepticus beim Erwachsenen sind leider seit 2017 abgelaufen und befindet sich derzeit in Überarbeitung (Leitlinie).
Das Wichtigste, um diese Patienten zu versorgen, möchten wir mit euch anhand der Leitlinie, aktueller Studien und anderer FOAMed Quellen beleuchten.
Definition
Wann dürfen wir überhaupt von einem Status epilepticus sprechen? Definiert ist ein Status epilepticus als „prolongierter epileptischer Anfall bzw. durch rezidivierende, d.h. mindestens zwei epileptische Anfälle ohne zwischenzeitliche Wiedererlangung des vorbestehenden neurologischen Befundes in einem umschriebenen Zeitraum“ (Leitlinie). Das heißt: jemand der vorher nicht orientiert war muss es hinterher auch nicht sein!
Was heißt nun aber prolongiert? Einige epidemiologische Studien sprechen von einer Dauer von mindestens 30 Minuten. Das ist eine für die Praxis eher unnütze Definition. Es würde uns (und wahrscheinlich auch euch) schon sehr schwer fallen, einem Patienten erst 30 Minuten beim Krampfen zuzuschauen, bevor man einschreitet.
Eine andere und praktikablere Definition spricht bereits ab einer Krampfdauer von 5 Minuten von einem Status. Diese Definition wird von uns und von den Leitlinien für den klinischen Alltag bevorzugt. Das heißt ja auch für die meisten Situationen: Besteht weiterhin Krampfaktivität wenn wir dazu kommen (insbesondere im Rettungsdienst), dann wird es sich höchstwahrscheinlich um einen Status handeln.
Stadien
Die Leitlinie unterscheiden 3 Stadien bei einem epileptischen Status:
- Die Initialphase (die ersten 10 Minuten): Es besteht noch eine relevante Wahrscheinlichkeit des spontanen Sistierens. Vorausgehen kann eine Phase mit für einen gegebenen Patienten ungewöhnlich häufigen Anfällen, die auch als drohender Status bezeichnet wird.
- Ein etablierter Status von mehr als 10 Minuten, meist bis 30, maximal 60 Minuten Dauer, der nicht auf die Initialtherapie mit Benzodiazepinen angesprochen hat.
- Ein refraktärer Status, der nicht auf adäquat dosierte Initial- und Sekundärtherapie mit einer zweiten Substanz angesprochen hat und in der Regel eine Dauer von mehr als 30–60 Minuten aufweist (Kurthen et al.).
Klassifikation
Generell kann man klassische tonisch, klonische Anfälle (Video) von aklonischen Anfällen (d.h. Anfälle ohne Bewegungsstörungen) unterscheiden. Aber auch zwischen diesen beiden Formen gibt es fast alle vorstellbaren Graustufen:
- „Subtle“ Status
- sehr aktives EEG mit kontinuierlich nachweisbarer epilepsietypischer Aktivität (generalisiertes Anfallsmuster oder epilepsietypische Einzelpotenziale) und gleichzeitig eine fehlende oder nur geringe motorische Aktivität (z.B. sehr leichte [„subtle“] Myokloni periorbital oder im Bereich der distalen Extremitäten) – elektromechanische Entkopplung.
- Fokaler konvulsiver und nonkonvulsiver Status epilepticus
- andauernder fokaler Anfall mit oder ohne Bewusstseinsstörung.
- Absence-Status
- Bewusstseinsstörung und fakultativ subtile motorische Phänomene bei typischerweise generalisierter bilateraler, im Verlauf irregulärer Spike-Wave-Aktivität im EEG
Auch die hier genannten Sonderformen sind nur eine kleine Auswahl und zum (großen) Teil nur unter kontinuierlicher EEG-Überwachung zu diagnostizieren. Wir überlassen dieses lieber den Experten und kümmern uns um das Akutmanagement.
Differentialdiagnosen
Neben einer bekannten oder neu aufgetretenen Epilepsie gibt es noch einige andere Ursachen für einen generalisierten Krampfanfall, die wir im präklinischen Setting oft nur vermuten können. Nichtsdestotrotz sollte man die relevanten Differentialdiagnosen kennen und immer eine vollständige Basisdiagnostik anstreben.
- metabolische Störungen
- Infektionen
- septische Krankheitsbilder
- Meningitis
- cerebrale Hypoxie
- akut bei ABC-Problem
- posthypoxische Hirnschädigungen
- Vergiftungen
- Alkohol
- Drogen
- Lokalanästhektika
- uvm.
- intracranielle Blutungen
- Schlaganfall / Ischämie
- cerebrale Raumforderung
- primärer Tumor
- Metastasen
- Eklampsie
- dissoziativer/psychogener Anfall (Pin-Up-Docs – Unterscheidung dissotiativer versus Grand Mal Anfall)
Diagnostik
Die Diagnostik sollte immer möglichst vollständig durchgeführt werden. (Auch ein bekannter Epileptiker kann einen Infekt entwickeln, Drogen genommen haben oder eine ICB entwickelt haben). Eine Diagnostik sollte IMMER unter Abwägung des Verletzungsrisikos für Patient und Personal erfolgen. Das heißt, eine umfassende Diagnostik kann auch erst nach einem medikamentösen Durchbrechen des Anfalls möglich sein.
Als allererstes sollte das Risiko von weiteren Verletzungen durch Freiräumen bzw. Abpolstern der Umgebung minimiert werden.
Präklinisch
- SpO2
- Blutzucker
- (VERGESST DEN SCHEIß BLUTZUCKER NICHT !!!!1!)
- 12-Kanal EKG
- höhergradige Rhythmusstörungen
- Temperatur
- Pupillenstatus
- körperliche Untersuchung zur Diagnostik von Verletzungen
- Begleitverletzungen (Zungenbiss)
- zu Grunde liegende Verletzungen (z.B. SHT)
Innerklinische Sofortdiagnostik
- Labor (bei mangelnder Evidenz sind dies unsere Vorschläge)
- Basis-Labor + BGA (Lactat!)
- kl. Blutbild
- Gerinnung
- Elektrolyte (Natrium, Kalium)
- Kreatinin
- Leberenzyme
- CK
- CRP
- Erweiterte Laborparameter bei Verdachtsfällen
- Alkohol- und Tox-Screening
- ggf. Medikamenten-Spiegel
- Vitamin B1, B6, B12, Folsäure
- Ammoniak (NH3)
- Harnstoff
- Lipase
- Basis-Labor + BGA (Lactat!)
- sofortiges cCT zum Ausschluss einer strukturellen Ursache
- ggf. MRT
- EEG
- insbesondere bei Therapieversagen zur Differenzialdiagnose (z.B. Ausschluss eines nicht-epileptischen Status)
- Monitoring zur Therapiekontrolle, z.B. zum Ausschluss oder Nachweis eines sich entwickelnden „subtle status epilepticus“ oder eines persistierenden nonkonvulsiven Status epilepticus
- evtl. Lumbalpunktion
- bei begründetem Verdacht
- nach Ausschluss von intrakranieller Druckerhöhung
Die weiterführende Diagnostik ergibt sich aus den bisher erhobenen Befunden.
Therapie
Eine Basistherapie mit O2-Gabe und peripher-venösem Zugang sollte so schnell wie möglich bzw. sobald möglich etabliert werden. Im Weiteren soll es hauptsächlich um die medikamentöse Therapie gehen.
Stufe I – Benzos
Nach einer ersten Abwägung der Gefahren sollte bei aktiv krampfenden Patienten eine Initialtherapie mit einem Benzodiazepin erfolgen. Welches am Besten? Eigentlich ist es völlig egal! Alle wirken! Die deutsche Leitlinie empfiehlt Lorazepam, jedoch mit mäßiger Evidenz (Prasad et al., lediglich im Vergleich zu Diazepam überlegen, kein Vergleich zu z.B. Midazolam).
Besonders wenn ihr keinen Zugang etablieren konntet, empfiehlt sich Midazolam, da man es sowohl i.m. als auch nasal geben werden kann (Pin-Up-Docs – nasale Medikamenten Gabe / MAD). Wobei in diesem Fall bessere Evidenz für die intramuskuläre Gabe gibt und diese wahrscheinlich bevorzugt werden sollte (Arya et al.). Am Ehesten ist dies darin begründet, dass wir bei der i.m. Gabe sicher wissen welche Menge Wirkstoff im Patienten gelandet ist. Nasal läuft leider doch ein Teil den Rachen runter und wir unterdosierten versehentlich. Am Ende entscheidet die Situation (Verletzungsgefahr für den Patienten und euch selbst) und womit ihr euch am wohlsten fühlt (Erfahrung).
Sollte dies alles nicht klappen, ist natürlich der i.o. Zugang (wie immer) eine Alternative. Hier solltet ihr bei krampfenden Patienten besonders auf euren Eigenschutz achten und den Patienten nicht weiter verletzen (Pin-Up-Docs – intraossärer Zugang).
| Wirkstoff | Kinder-Dosis | übliche Dosis | ||
| Lorazepam i.v. | 0.1mg/kg | 4-8mg | ||
| Midazolam i.v. | 0.1mg/kg | 5-10mg | ||
| Midazolam nasal | 0.2mg/kg | |||
| Midazolam i.m. | 0.2mg/kg | 5-10mg | ||
| Diazepam i.v. | 0.2mg/kg | 10mg |
Die Angst vor einer Atemdepression wird wahrscheinlich überbewertet, da die Hypoxiegefahr im Status als schlimmer einzustufen ist (Glauser et al.).
Wenn es nach 4 Minuten nicht zum Sistieren des Anfalls gekommen ist, sollte eine weitere Dosis Benzos versucht werden (Glauser et al.; Claassen et al.).
Stufe II
Was wenn auch eine wiederholte Benzogabe nicht reicht? Die Leitlinien empfehlen meist Phenytoin, Levetiracetam (Keppra), Valproat oder Phenobarbital (Leitlinie; Claassen et al.). Gerade die Evidenz bzgl. Levetiracetam hat in den letzten Jahren erheblich zugenommen (Alvarez et al.). Phenytonin ist so eine Sache, besonders wegen der Wechselwirkungen mit anderen Antiepileptika (aber auch sonstigen Medikamenten – die Liste erscheint endlos) (Fachinformation Phenytoin). Wenn Keppra greifbar ist würden wir Keppra bevorzugen und eine Gabe möglichst schon parallel zur 2. Benzpdiazepin Gabe beginnen.
Allerdings haben diese Medikamente einige erhebliche Nachteile:
- ich habe sie nicht überall (schnell) verfügbar (NEF, ITS usw.)
- sie wirken (eher) langsam
- einige relevante Kontraindikationen (z.B. Intoxikationen) können im präklinischen / Notfall-Setting nicht immer ausgeschlossen werden (Sharma et al.).
Daher empfehlen wir (besonders wenn ihr Keppra gerade nicht zur Hand habt) Propofol 1.5-2 mg/kg i.v. frühzeitig einzusetzen. (Marik et al.; Glauser et al; Farkas et al.) (First10EM – Propofol in Status Epilepticus).
Zugegeben, die Evidenz dahinter ist auch nicht überwältigend, ABER:
- Es ist (genau wie Benzos) ein GABA-Agonist
- Es ist (fast) immer verfügbar
- Wir (Notfallmediziner) kennen uns damit aus
- sollte eine vollständige Narkoseeinleitung notwendig sein, können wir es weiter nutzen und müssen uns keine Gedanken über Medikamenteninteraktionen machen
- schneller Wirkeintritt
- kurze Wirkdauer (CAVE: ggf. Perfusor nötig)
Es gibt bessere (z.T. auch ältere) Evidenz zu Barbituraten (Phenobarbital oder Thiopental). Allerdings sind diese in Deutschland nicht sehr verbreitet, sodass die jeweilige Verfügbarkeit und das sichere Handling (Testdosis, Medikamenteninteraktionen, etc.) individuell abgewogen werden muss (First10EM – Phenobarbital second line in Status epilepticus; DGNI – Management des therapierefraktären generalisierten konvulsiven Status epilepticus).
Natürlich sollte ergänzend möglichst schnell (Verfügbarkeit / Kontraindikationen) mit Phenytoin (20 mg/kg über 20 Minuten) oder Levitiracetam (60 mg/kg als KI) begonnen werden.
Alternativen / Ergänzungen zu Propofol
- Ketamin
- wenn auch nicht mit viel Evidenz untermauert, kann die ergänzende Gabe von Ketamin Sinn machen. (Benzos + Propofol = GABA-Rezeptor / Ketamin = NMDA-Rezeptor) (Borris et al.; Fang et al.)
Als weitere Alternativen sind experimentelle Ansätze mit Inhalationsanästhetika oder Lidocain zu nennen, welche nur im Konsens mit Experten und im intensivmedizinischen Setting durchgeführt werden sollten (Holtkamp et al.; Murao et al.; De Giorgio et al.).
Atemwegsmanagement
Viele Patienten werden nach Stufe II eine Atemwegssicherung benötigen. Da eine adäquate Präoxygenierung quasi unmöglich ist, besteht ein hohes Risiko für Entsättigung. Daher sollten wir uns parallel zu Stufe I und II schon Gedanken über das Atemwegsmanagement machen. Gerade bei schlechten Ausgangssättigungen stellt das Aspirationsrisiko (der Patient ist höchstwahrscheinlich nicht nüchtern) nur eine relative Kontraindikation dar. Für den Fall einer Entsättigung sollte eine Beutel-Masken-Beatmung oder sogar ein supraglottischer Atemweg greifbar sein und auch benutzt werden (natürlich unter kontinuierlicher Absaugbereitschaft). Die weitere Narkoseeinleitung sollte als RSI erfolgen (Pin-Up-Docs – Notfallnarkose).
Allerdings ergibt sich daraus ein Problem: Die Verwendung eines Muskelrelaxans führt zu einem Sistieren der tonisch-klinischen Bewegungen (bei der Verwendung von Rocuronium in RSI-Dosis [1 – 1,2 mg/kg] kann die Blockade leicht über eine Stunde anhalten), sodass es sein kann, dass der Patient unbemerkt weiter krampft. Succinylcholin stellt allerdings aus unserer Sicht keine Alternative dar, da ohnehin evtl. schon erhöhte Serum-Kalium-Spiegel (durch die Muskelkrämpfe mit evtl. beginnender Rhabdomyolyse) noch weiter ansteigen könnten. Eine Intubation ohne Muskelrelaxans macht zwar unter diagnostischen Gesichtspunkten Sinn, verbietet sich aus unserer Sicht aber in jeder Notfallsituation. Daher ergeben sich nach der erfolgreichen Intubation zwei Optionen:
- Antagonisierung des Muskelrelaxans
- kontinuierliches EEG-Monitoring sobald möglich
Gerade bei einer Patientenübergabe sollte explizit auf die anhaltende Relaxierung hingewiesen werden.
Therapie der Differentialdiagnosen
Natürlich sollten alle Differentialdiagnosen (s.o.) ausgeschlossen oder entsprechend behandelt werden (Vergesst den Scheiß Blutzucker nicht!!!!)
Sonderfall: Eklampsie
Eklampsie sollte bei allen Frauen im gebärfähigen Alter in Erwägung gezogen werden. In der fortgeschrittenen Schwangerschaft sollte es ja leicht zu sehen sein (CAVE: es gibt falsch negative). Aber Eklampsie kann auch bis zu 8 Wochen nach einer Schwangerschaft auftreten.
Therapie: 4 g Magnesium i.v.
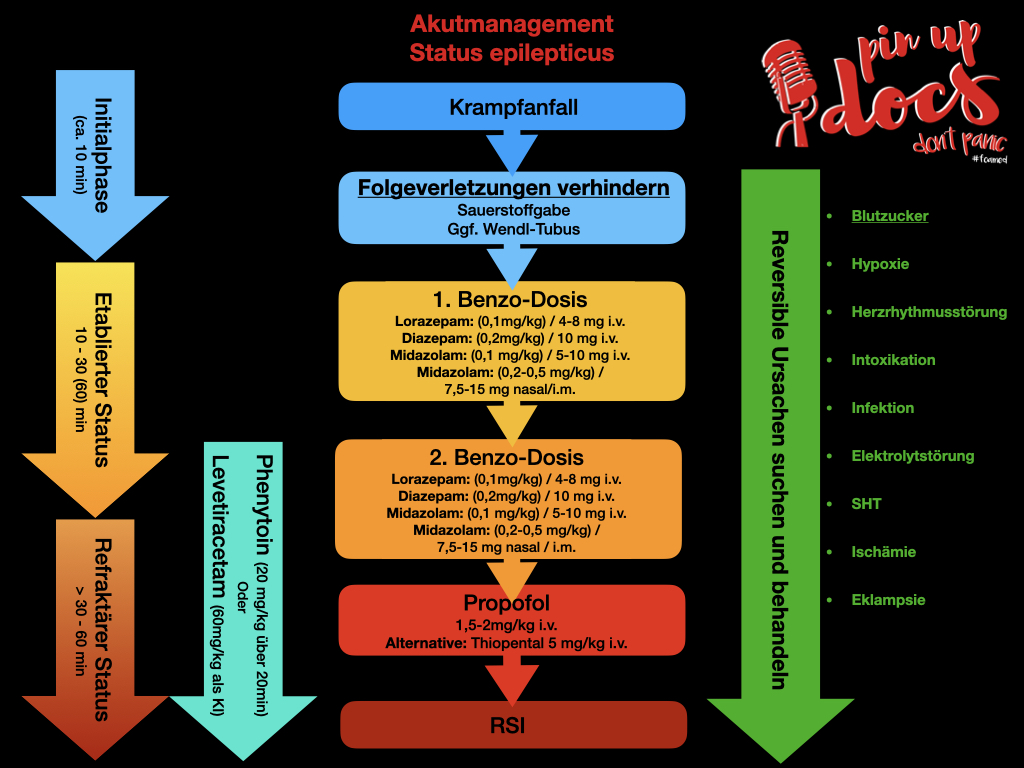
Punchlines

- weitere Verletzungen verhindern (Patient und Personal)
- Basismaßnahmen
- O2-Gabe
- Blutzuckermessung
- Monitoring
- 1. Stufe: Benzodiazepine (fast egal welches)
- 1x wiederholen
- 2. Stufe: Propofol
- oder ggf. Thiopental
- Atemwegsmanagement bereithalten
- evtl. Ketamin ergänzen
- Bei Relaxierung (ÜBERGABE)
- EEG oder Antagonisierung
- Eklampsie?
- Magnesium
Update 23.07.2020
- Keppra parallel zur zweiten Benzodiazepin Gabe wenn verfügbar.
- Phenytoin zurückhaltend
- Keppra Stufe II der Wahl für uns.
- Stufe II nicht überspringen!
- Intramuskuläre Benzodiazepin Gabe bevorzugen.
- Flowchart Akutalisiert

Autoren
Dr.med. Thorben Doll, Arzt in Weiterbildung Anästhesiologie, aktiver Notarzt, lernte die Notfallmedizin von der Pike auf kennen, präklinische Erfahrung 17 Jahre und Gründer von Pin-Up-Docs.de
Johannes Pott, Arzt in Weiterbildung Anästhesiologie, aktiver Notarzt, Lieblingsbaustelle ist die Intensivstation. Seit 16 Jahren im Rettungsdienst und Gründer von Pin-Up-Docs.de
Andere Quellen
DGN – Leitlinie (2017 abgelaufen)
DGNI – Management des therapierefraktären generalisierten konvulsiven Status epilepticus.
Quellen
Sharma AN, Hoffman RJ. Toxin-related seizures. Emergency medicine clinics of North America. 29(1):125-39. 2011. PMID: 21109109
Marik PE, Varon J. The management of status epilepticus. Chest. 2004; 126(2):582-91.
Kurthen M, Schneider D. Pharmakorefraktärer Status epilepticus. Intensivmed up2date 2011; 7: 133–143


Schöner Artikel ! – Trapanal scheint sich gar nicht mehr zu finden (i.S.e. RSI)
Interessant wäre noch eine Abgrenzung zu psychogenen Krampfanfällen. DD.
Moin Oliver,
freut uns wenn es dir gefällt.
Thiopental ist der Wirkstoff von Trapanal.
Die Abgrenzung zu psychogenen Anfällen ist leider super schwierig. Vielleicht machen wir irgendwann mal was dazu…
liebe Grüße
Thorben
Ich weiss was thiopental ist 🙂 bei uns Standard RSI präklinisch.
Sorry Oliver, wir haben uns falsch verstanden. Johannes und ich sind große Freunde von Thiopental wir sehen nur zunehmend Probleme:
1. Es wird innerklinisch (bei uns) fast gar nicht mehr benutzt.Damit nimmt auch die Erfahrung ab.
2. Der Vorteil gegenüber Propofol ist bei adäquater Dosierung gering
Wie siehst du das ?
Für die Abgrenzung zum psychogenen Anfall fehlen uns vernünftige Quellen, um evidenzbasiert zu sprechen…..
Wie siehst du das?
Liebe Grüße
Thorben
undich weiß auch, dass die Abfernzung super schwierig ist – gerade deswegen ist es ja so interessant.
Hey Oliver,
ich mache die Abgrenzung psychogener Anfall vs. Grand Mal Anfall in unserem Juli Podcast – falls du reinhören möchtest ;).
Wird es dann auch als Tabelle in den Shownotes unseres Juli Podcast zum Nachlesen geben.
Liebe Grüße
Thorben
Pingback: Unterscheidung psychogener/dissoziativer Krampfanfall vs Grand Mal Anfall - pin-up-docs - don't panic
Pingback: Lokalanästhetikaintoxikation - pin-up-docs - don't panic