ECMO – Die Lösung für unsere Probleme?

Extracorporeal Membrane Oxygenation – ECMO
Wenn man als Assistenzarzt oder Assistenzärztin zum ersten Mal auf einer Intensivstation eingesetzt wird, dann hat man viele Erwartungen und sicherlich auch Ängste. Aber auch hier gilt immer primär unser Grundsatz „don’t panic!“, denn ECMO-Therapie ist Team-Arbeit und gerade erfahrene KollegInnen können einem helfen!
Wir wollen deshalb das große Thema ‚ECMO-Therapie‘ in diesem Artikel erläutern und für Euch aufarbeiten.
Die ECMO ist ein extrakorporales Unterstützungssystem, welches ein Organersatzverfahren darstellt und durch einen externen Bypass sauerstoffarmes Blut mit Sauerstoff anreichert, gleichzeitig CO2 eliminiert und dem Patienten danach wieder zuführt.
Es gibt zwei unterschiedliche Arten von ECMO-Therapie: Die VV-venovenöse-ECMO und die VA-venoarterielle-ECMO. Bei einer VV-ECMO wird „nur“ die Lungenfunktion ersetzt. Bei der VA-ECMO wird zusätzlich auch noch die Herzfunktion unterstützt beziehungsweise ersetzt.

VV-ECMO:
Venöses Blut wird über eine großlumige Kanüle aus einer zentralen Vene entnommen und in Richtung der ECMO-Pumpe befördert. In diesem Teil des Systems herrscht ein Unterdruck. Das Blut wird dann weiter in Richtung Oxygenator gepumpt, wo über eine gasdurchlässige Membran die Oxygenierung stattfindet. Auf der anderen Seite der Membran liegt ein Frischgasfluss. Nach erfolgter Oxygenierung wird das Blut wieder zurück in eine, meist andere, zentrale Vene vor das Herz gepumpt. Hier herrscht also ein Überdruck.
VA-ECMO:
Auch hier wird das Blut über eine zentrale Vene entzogen und über die Pumpe in den Oxygenator befördert. Allerdings wird das oxygenierte Blut anschließend zurück in eine Arterie (meist die A. femoralis oder in der Kardiochirurgie über eine aortale Kanüle) gepumpt und kann somit die Funktion des linken Ventrikels vollständig ersetzen.
CAVE: „Harlekin-Phänomen“: Die Blutströme des linken Ventrikels und der VA-ECMO konkurrieren in diesem Fall. Bei pulmonalem Versagen wirft das Herz schlecht oxygeniertes Blut aus, die ECMO liefert gut oxygeniertes Blut. Es hängt sowohl von der kardialen Pumpleistung als auch vom ECMO-Blutfluss ab, wo genau diese beiden Ströme aufeinander treffen, der genaue Ort lässt sich nur schwierig bestimmen. Somit besteht ein Risiko, dass die obere Körperhälfte (und somit besonders auch die Koronarien und hirnversorgenden Gefäße) mit nicht ausreichend oxygeniertem Blut perfundiert werden. Zur Überwachung der zerebralen und kardialen Oxygenierung müssen sowohl das SpO2-Monitoring als auch die Abnahme von BGAs am rechten Arm erfolgen, denn er ist aufgrund der Anatomie der Ort des höchsten Anteils an Mischblut. Alternativ kann ein NIRS-Monitoring erfolgen. Das Risiko eines kardialen oder zerebralen Sauerstoffmangels kann durch die Implantation einer zusätzlichen venösen Kanüle zur Rückgabe von oxygeniertem Blut in die V. jugularis reduziert werden (VAV-ECMO). Dadurch wird ein Teil des in der ECMO oxygenierten Blutes dem kleinen Kreislauf zur Verfügung gestellt.
Extrakorporale Oxygenierung:
MERKE: Der Blutfluss (l/min) ist die treibende Kraft für die Oxygenierung. Niedrige Blutflussraten um 1 l/min (bei 1l/100% O2) beeinflussen die Oxygenierung nur unwesentlich, erlauben aber eine Decarboxylierung; hohe Bluttflussraten um 5 l/min (bei 1l/100% O2) entsprechen etwa der maximalen Oxygenierung.
- Der Blutfluss ist limitiert durch die Kanülengröße und den Volumenstatus des Patienten
- Der Sauerstofftransfer ist abhängig von der Sauerstoffpartialdruck-Differenz zum Blut, der Hämodynamik und dem Hämatokrit des Patienten, der Sauerstoffbindungskapazität (konstant 1,36 ml/g) sowie dem Zustand der Oxygenatormembran.
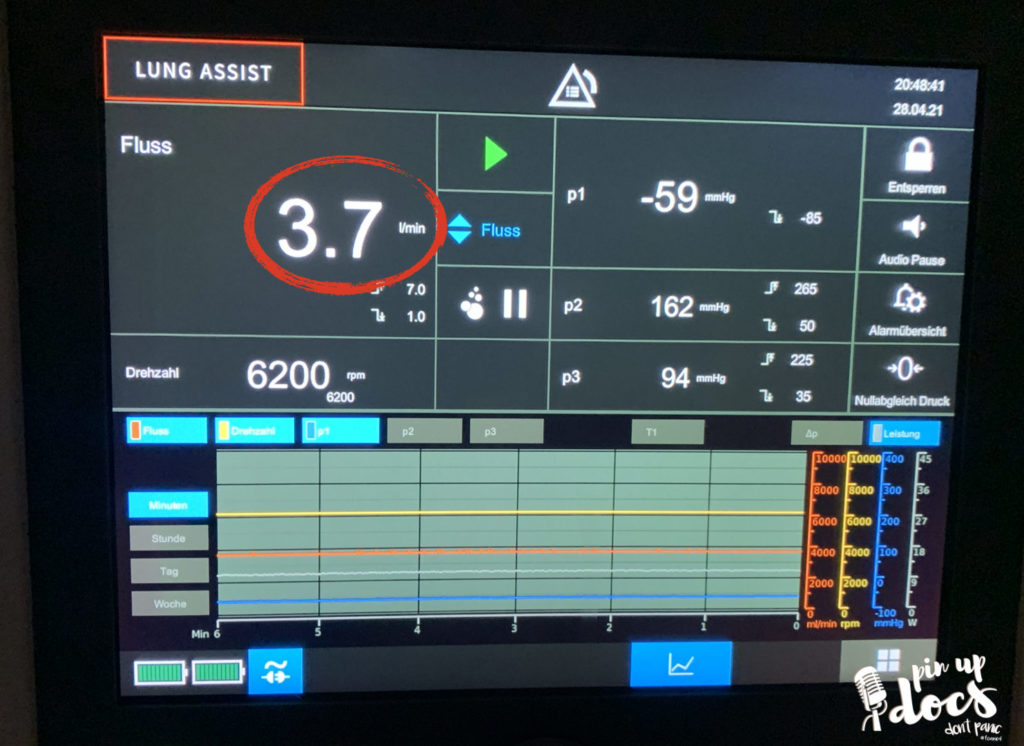
Extrakorporale Kohlendioxidelimination:
MERKE: Der Gasfluss durch die Hohlfasern des Oxygenators (eingestellt am O2-Flowmeter) bestimmt das Ausmaß des Kohlendioxidtransfers. 1l/min Gasfluss entspricht einer minimalen CO2-Elimination; 10 l/min Gasfluss erlauben maximale CO2-Elimination.

Systemischer Blutdruck:
MERKE: Der systemische Blutdruck ergibt sich aus dem Blutfluss und dem arteriellen Tonus. (Sidebotham et al.)
Indikationen: (aus „Das ICU-Buch“)
- VV-ECMO:
- „Bridge to decision“ – Sicherung des Gasaustauschs und Schaffung eines Zeitintervalls zur Heilung
- bei akutem Lungenversagen im Sinne eines ARDS (s.u.)
- bei einem Thoraxtrauma
- bei einem akuten Abdomen
- „Bridge to transplant“
- „Bridge to decision“ – Sicherung des Gasaustauschs und Schaffung eines Zeitintervalls zur Heilung
- VA-ECMO:
- „Bridge to recovery“ – zum Beispiel nach kardiochirurgischer OP und initial frustranem HLM-Weaning (Herz-Lungen-Maschine).
- „Bridge to decision“
- schnelle Sicherung der Organperfusion und Schaffung eines Zeitintervalls bis zu einer Intervention/OP bei einem kardiogenen Schock mit akutem oder chronischem Pumpversagen, z.B. durch:
- Akuten Myokardinfarkt
- Fulminante Myokarditis
- Lungenarterienembolie
- Fulminante (septische) Kardiomyopathie
- prolongierte Reanimation
- schnelle Sicherung der Organperfusion und Schaffung eines Zeitintervalls bis zu einer Intervention/OP bei einem kardiogenen Schock mit akutem oder chronischem Pumpversagen, z.B. durch:
- „Bridge to bridge“
- Zur Schaffung eines Zeitintervalls bis zum Einsatz eines Langzeit-Assist-Systems (VAD)
- „Bridge to transplant“
- Zur Vermeidung einer Intubation
Indikation einer VV-ECMO-Therapie bei einem ARDS: (Sidebotham et al., Peek GJ et al.)
- Versagen einer „lungenprotektiven Beatmung“ unter iNO-Therapie und Bauchlagerung
- Horovitz-Index < 50 unter einer FiO2 von 1,0 und PEEP > 10 mBar
- Plateaudrücke >32 mBar und Horovitz 60-80 für > 6h
- guter funktioneller Status (keine fixe Altersgrenze)
- Murray-ARDS-Score ≥ 3
Relative Ausschlusskriterien – Einzelfallentscheidung:
- Schwere irreversible Grunderkrankung (z.B. Lungenfibrose ohne Transplantationschance)
- Maligne Grunderkrankungen mit 5-Jahres-Überlebenswahrscheinlichkeit <50%
- Akute Blutung (relative KI), DIC oder akute ICB
- prolongierte Beatmungszeit vor ECMO-Anlage (>7-10 d) mit hohen Beatmungsdrücken und hoher FiO2
Murray-Score:
| 0 | 1 | 2 | 3 | 4 | |
| paO2/FiO2 | >300 mmHg | 225-299mmHg | 175-224mmHg | 100-175mmHg | <100 mmHg |
| Quadranten mit Infiltraten | 0 | 1 | 2 | 3 | 4 |
| PEEP in cmH2O | 0-5 | 6-8 | 9-11 | 12-14 | >15 |
| Compliance in ml/cmH2O | >80 | 60-79 | 40-59 | 20-29 | <29 |
| Gesamtsumme dividiert durch 4 ergibt den Murray-Score-Wert: 0 kein Lungenversagen, >2-5 leichtes Lungenversagen, >2,5 schweres Lungenversagen |
Beatmung unter ECMO-Therapie
VV-ECMO: -> An der VV-ECMO in der Regel eine FiO2 von 1,0
Ultraprotektive Standardbeatmungsparamter initial nach ECMO-Anschluss:
- AF: 8-12/min
- Atemzugvolumina 3-5 ml/kgKG (Idealgewicht)
- Pinsp <20-25 mbar, PEEP 10-15 cmH2O
- FiO2 nach paO2 (Ziel 70-90 mmHg)
- Frühzeitig augmentierte Beatmungsformen: BIPAP/CPAP, um einer Hypo-/Atrophie der Atemhilfsmuskulatur vorzubeugen
- Negativbilanz anstreben
VA-ECMO: -> Hier muss die pulmonale UND die kardiologische Funktion beachtet werden:
- Pulmonal siehe VV-ECMO -> Auch hier: Negativbilanz anstreben
- Kardial: Einschätzung mittels (TTE)/TEE zur Beurteilung der LVEF
- Milrinon erwägen: = Phosphodiesterase-III-Hemmer; positiv inotrop und vasodilatierend zur Therapie der theraierefraktären schweren Herzinsuffizienz, Senkung von „Preload“ und „Afterload“, Steigerung der kardialen Auswurfleistung (überwiegend renal eliminiert, Dosierung: initial: 50 µg/kgKG, dann 0,375-0,75 µg/kg/min, max. 2 d, Anpassung an Niereninsuffizienz)
- Dobutamin erwägen, positiv inotrop, (positiv chronotrop), Kurzzeittherapie der akuten Herzinsuffizienz (2,5-10 µg/kgKG/min) bei vermindertem HZV
- Levosimendan erwägen: „Calciumsensitizer“ wirkt positiv inotrop über eine Bindung an Troponin C in Myozyten und erhöht die Empfindlichkeit gegenüber der in der Systole erhöhten Ca2+-Konzentration (hepatische Elimination, bedingt eine 7-9 Tage anhaltende hämodynamische Wirkung) CAVE: Hypotension!
Initiale Einstellung und Ziele nach Etablierung der ECMO-Therapie (Sidebotham et al.)
- Blutfluss 50-80 ml/kg/min
- FiO2 an ECMO: 1,0
- pH und PaCO2 im Normbereich bis milde Hyperkapnie
- MAP 65-95 mmHg
- Hkt 30-40%
- >100.000 Thrombozyten
CAVE: Abhängig von der Größe der implantierten arteriellen Kanüle besteht bei der VA-ECMO die Gefahr einer Ischämie der Extremität. In diesem Fall wird eine zusätzliche – nach distal gerichtete – arterielle Schleuse (z.B. in die A. femoralis) eingelegt und mittels einer T-Verbindung vom arteriellen Schenkel gespeist, zur distalen Perfusion. Häufig wird diese bei entsprechender Größe der Kanüle auch schon prophylaktisch angelegt.

Antikoagulation:
VV-ECMO: z.B. mittels UFH -> aPTT erhöhen um das 1,5-fache, CAVE: ggf. höhere Antikoagulation nach Grunderkrankung notwendig (Alternative: Argatroban, Start mit 0,2µg/kgKG/min ca. für eine Ziel-aPTT von 50 sec)
VA-ECMO: z.B. mittels UFH -> aPTT erhöhen um das 2-3-fache, CAVE: ggf. höhere Antikoagulation nach Grunderkrankung notwendig
Eine Antikoagulation mittels Heparin ist möglich, allerdings muss wie immer bei einer Thrombozytopenie eine HIT ausgeschlossen werden. Aufgrund der bei kritisch kranken Patienten häufiger vorkommenden Thrombozytopenien wird in manchen Häusern während der ECMO-Therapie grundsätzlich Argatroban verwendet. Hierbei ist die Dosierung zu beachten (Beiderlinden M et al.), die mit 0,2 mg/kg/min deutlich niedriger beginnt, als in den Empfehlungen der Beipackzettel.
Überwachung:
Neben der Standard-Überwachung, wie einer arteriellen Blutdruckmessung und ständiger Reanimationsbereitschaft, sollte eine NIRS-Messung durchgeführt werden. Bei einer VA-ECMO ist die Messung obligat. (siehe Harlekin-Phänomen)
Troubleshooting: Wo ist das Problem? / Was mache ich wenn? (Sidebotham et al.)
- Niedrige SaO2
- Mögliche Ursachen:
- Oxygenator-Versagen: Prä-Oxy-Gas und Post-Oxy-Gas checken und Oxy ggf. tauschen
- Diskonnektion der O2-Versorgung: Verbindungen prüfen
- O2-Verbrauch steigt (VV) -> Blutfluss , Sedierung vertiefen, ggf. relaxieren, Fieber vermeiden, ggf. Blut transfundieren
- Reduzierte Lungenfunktion (VV) -> Blutfluss steigern
- Harlekin-Phänomen -> Blutfluss steigern; Wechsel auf VAV oder VV-ECMO
- Mögliche Ursachen:
- Blutungen
- Mögliche Ursachen:
- Koagulopathien -> Überprüfen mittels differenzierter Betrachtung der Gerinnungsparamter und Ausgleich der Störung
- Erworbenes von Willebrand-Syndrom -> Substitution von vWF und Faktor XIII
- Blutungen an den Kanülen -> Blutprodukte transfundieren, ggf. aPTT-Ziel verändern, Heparin-Zufuhr kurzfristig unterbrechen, chirurgisches Vorgehen erwägen
- Gastrointestinale Blutung -> Endoskopie + oben genanntes
- Blutung in den Atemwegen -> Bronchoskopie + oben genanntes
- Mögliche Ursachen:
- Hoher (negativer) „Ansaugdruck“ (bei Zentrifugalpumpen)
- Mögliche Ursachen:
- Hypovolämie -> Volumenstatus überprüfen und ausgleichen
- Herzbeuteltamponade (VV) -> TTE/TEE -> Drainage/ OP, sofern nötig
- Spannungspneumothorax -> Sono/ (Röntgen) -> Drainage
- Mögliche Ursachen:
- Hypotension
- Mögliche Ursachen:
- Hypovolämie oder Blutverlust -> Volumenstatus überprüfen und ggf. ausgleichen, nach Blutungsquellen suchen
- Exzessive Vasodilatation / Sepsis -> TTE/TEE + symptomatische und kausale Behandlung der Sepsis
- Herzbeuteltamponade (VV) -> TTE/TEE -> Drainage/ OP, sofern nötig
- Spannungspneumothorax -> Sono/ (Röntgen) -> Drainage
- Myokardiale Dysfunktion -> TTE/TEE, ggf. Inotropie erwägen?
- Mögliche Ursachen:
Praktische Hinweise:
Wenn sich die ECMO ansaugt liegt oft ein intravasaler Volumenmagel vor, der ausgeglichen werden muss. Bleibt die ECMO zu lange stehen, gerinnt das Blut. Kurz hinter den einliegenden Kanülen muss in diesem Fall der Schlauch abgeklemmt werden (es müssen IMMER genügend geeignete Klemmen am Bett sein) und die Kanülen müssen über den proximalsten Drei-Wege-Hahn gespült werden, damit ein neues Set aufgebaut werden kann. CAVE: Luftembolien.
Es sollte immer ein aktueller Anforderungsschein für Kreuzblut vorhanden sein. Bei der aktuellen Knappheit an Blutkonserven sollte aber darauf achten, keine übertriebenen Mengen vorzuhalten, damit diese nicht häufig im Verlauf verfallen.
Was ist in dieser Situation wichtig:
- Beatmung: FiO2 1,0 und auf eine vollständige Beatmung umstellen!
- Kardiopulmonale Reanimation einleiten, sofern Patient einen Herz-Kreislauf-Stillstand hat!
- Katecholamine bei hämodynamischer Instabilität!
Weaning:
- VV-ECMO: Der Blutfluss kann analog zur Erholung des pulmonalen Gasaustauschs schrittweise reduziert werden, gleichzeitig sollten die Beatmungsparameter angepasst werden: Plateaudruck < 30 mbar, PEEP < 15 mbar, FiO2 0,5-0,6. Die Lunge sollte 80% der Oxygenierung übernehmen können – CPAP, ASB ≤ 6 mBar, FiO2 <0,4, paO270-90 mmHg, paCO2 <50 mmHg. Bei einem Blutfluss von 1,5-2 l/min und einem Frischgasfluss von 0 l/min ist das Weaning-Ziel erreicht.
- Die Erholung der Lunge wird in einem ein- bis dreiwöchigen, teilweise auch längerem Zeitraum erreicht. Hinweise auf Erholung sind eine Verbesserung der SaO2 bei gleichbleibendem Blutfluss, ein Anstieg der SaO2 über die SvO2, eine verbesserte Compliance der Lunge und ein Rückgang der radiologischen Zeichen des ARDS.
Technische Hinweise:
Zeichen für ein Blut-Koagel / „Embolus“ im ECMO-Kreislauf: (Sidebotham et al.)
- Koagel im Pumpenkopf:
- Verändertes Pumpengeräusch
- stetige Erhöhung des (freien) Plasma-Hämoglobins
- Koagel im Oxygenator:
- Zunehmender Druckgradient vor und hinter dem Oxygenator
- Abfall des PaO2 im post-Oxygenator-Gas
- Notwendigkeit der Erhöhung des Gasflusses um einen gleich bleibenden paCO2 zu generieren
- Generelle Zeichen: Anstieg der D-Dimere (CAVE: Bei Covid-19 Patienten auf ITS meist generell stark erhöht)
Pumpensystem:
Die inzwischen gängigen ECMO-Systeme sind Zentrifugalpumpen, die im Gegensatz zu Rollerpumpen weniger Hämolyse verursachen, eine längere Haltbarkeit aufweisen und weniger „nachlastabhängig“ sind. (Es kam bei Rollerpumpen vor, dass durch eine obstruktionsbedingte Druckerhöhung hinter dem Oxygenator Schlauchmaterial geplatzt ist.)
- Zentrifugalpumpen: (Sidebotham et al.)
- Bestehen aus einem Pumpenkopf und einem Impeller – ein Propeller, der von einem ring- oder röhrenförmigen Gehäuse umschlossen ist. Durch die Drehung des Impellers entsteht ein Druckgradient, der das venöse Blut in den Pumpenkopf saugt. -> Hieraus kann sich die Schwierigkeit entwickeln, dass sich die Kanüle, z.B. bei Hypovalämie, ansaugt.
- Es ist eine gesonderte Flow-Messung hinter dem Oxygenator notwendig, hierbei werden gleichzeitig auch Luftblasen detektiert.
- Zentrifugalpumpen-Systeme sind vor- und nachlastabhängig (aber weniger nachlastabhängig als Rollerpumpen)

Oxygenator-Unterschiede:
Je nach Zusammensetzung und Aufbau der Oxygenatoren haben sie eine unterschiedliche Lebensdauer und es wird zum Teil ein separater Wärmetauscher benötigt.

Kurze Anmerkung zur Vorbereitung:
Die Systeme sollen vor der Befüllung mit Flüssigkeit mit CO2 geflutet werden, damit etwaige Luftembolien vom Körper besser resorbiert werden können.
Relevante Druckwerte:
Um eine Überwachung der ECMO zu gewährleisten, zeigen viele Geräte die unterschiedlichen Druckwerte vor der Pumpe, vor dem Oxygenator und nach dem Oxygenator an. Diese Werte sind als Verlaufsparameter zu betrachten und dienen der Einschätzung der Leistung und möglicher Probleme.
- P1 – Reservoir-Druck: VOR der PUMPE angeschlossen (venöser Negativdruck)
- Bestimmt, ob ein Problem mit dem Oxygenator vorliegt
- Probleme: P1 wird extrem negativ
- Katheter hat sich angesaugt
- Patient hat intravasal einen Volumenmangel
- der eingestellte Blutfluss ist für das Katheterlumen zu hoch
- Probleme: P1 wird extrem negativ
- Bestimmt, ob ein Problem mit dem Oxygenator vorliegt
- P2 – Prämembranös (Oxy 1) -> wird VOR dem OXYGENATOR angeschlossen
- Bestimmt, ob ein Problem mit dem Fluss in den Patienten vorliegt
- Probleme: Oxy ist zugeclottet; oder P2 ist hoch, weil P3 hoch ist
- P3 – Postmembranös -> Wird am Y-Stück HINTER dem OXYGENATOR angeschlossen
- Bestimmt, ob ein Problem mit der Blutrückführung in den Patienten vorliegt
- Probleme: Zuführender Katheter liegt an Gefäßwand an; Katheter ist zugeclottet
Diese Druckwerte sind von unterschiedlichen Faktoren abhängig, weshalb keine genauen Grenzen genannt werden können, sondern die einzelnen Parameter als Verlaufsbeurteilung dienen.

Kanülengrößen: (grobe Orientierung)
V. femoralis: 25-23 (Fr) Männer; 23-21 (Fr) Frauen
V. jugularis: 21-19 (Fr) Männer; 19-17 (Fr) Frauen
Weitere Bilder:

Autorin
Dana Maresa Spies
Quellen:
- „SOP ECMO-Therapie“ Klinik für Anästhesie und Intensivtherapie UKGM, PD Dr. T. Wiesmann (Herzlichen Dank, dass ich mich hieran orientieren durfte, lieber Thomas!)
- “Das ICU-Buch – Praktische Intensivmedizin” Paul L. Marino ; ISBN: 978-3-437-23162-9
- „Extrakorporale Membranoxygenierung“ in der A&I: https://www.ai-online.info/images/ai-ausgabe/2018/06-2018/2018_6_316-325_Extrakorporale%20Membranoxygenierung.pdf
- Thomas Karow, Ruth Lang-Roth: “Allgemeine und Spezielle Pharmakologie und Toxikologie”, 29. Auflage, ISBN 9 783982 122311
Veröffentlichungen zum Thema:
1. Sidebotham D, McGeorge A, McGuinness S, Edwards M, Willcox T, Beca J. Extracorporeal membrane oxygenation for treating severe cardiac and respiratory failure in adults: part 2-technical considerations. J Cardiothorac Vasc Anesth. 2010;24(1):164-72.
2. Peek GJ, Clemens F, Elbourne D, Firmin R, Hardy P, Hibbert C, et al. CESAR: conventional ventilatory support vs extracorporeal membrane oxygenation for severe adult respiratory failure. BMC Health Serv Res. 2006;6:163.
3. Combes A, Hajage D, Capellier G, Demoule A, Lavoué S, Guervilly C, et al. Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome. N Engl J Med. 2018;378(21):1965-75.
4. Beiderlinden M, Treschan T, Görlinger K, Peters J. Argatroban in extracorporeal membrane oxygenation. Artif Organs. 2007;31(6):461-5.

Mensch Dana – supercool :-).
Danke, lieber Tobias! =)
Hallo.
Erst mal vielen Dank fuer die kurze Abhandlung.
Ich hab mal noch eine Frage, bei einer Reanimationssituation wir die Drehzahl dann hochgenommen oder runtergedreht und ergänzend dazu die Frage, was tun, wenn ein Cytosorb Filter dazwischen geschaltet ist?
Besten Dank für die Mühen!!
Hallo Lisa,
Antwort inkl. eines kleinen zusätzlichen Nachtrags:
vielleicht könntest du uns die genaue klinische Situation schildern, die hinter deiner Frage steckt?
Ansonsten muss ich um diese Frage möglicherweise zu beantworten, etwas ausholen, versuche aber auf die für mich in einer solchen Situation wichtigen Punkte einzugehen .. Hier handelt es sich aber um meine eigenen Ansichten und nicht um ein vollständig evidenzbasiertes Wissen..
Wie immer: Erstmal versuchen ruhig zu bleiben (don’t panic), Hilfe holen und unbedingt an das Trouble-Shooting denken: Eine ausreichende Beatmung am Respirator unter einer FiO2 von 1,0 einstellen und auch an der ECMO eine FiO2 von 1,0 etablieren.
Die nächste Frage ist (und das sollte man natürlich bei seinen eigenen PatientInnen wissen):
– Handelt es sich um eine VV-ECMO oder eine VA-ECMO?
UND:
– Ist es ein Problem, welches durch die ECMO-Therapie bedingt ist, oder ist es ein „patientenseitiges“ Problem? (Beispiele: Oxygenator ist akut geclottet (ECMO-Problem führt zu Reanimation) vs. akuter Volumenmangel durch Blutung (patientenseitiges Problem führt zu Reanimation)).
Bei einer VA-ECMO-Therapie sollte ja eigentlich die Funktion des Herzens und der Lunge (anteilig) „ersetzt“ werden. Hierunter ist also eine Blut-Zirkulation und die Oxygenierung (sofern es kein „ECMO-Problem“ selbst ist) gewährleistet. Ggf. kann bei einer VA-ECMO-Therapie der Blutfluss noch erhöht werden, um die Oxygenierung zu verbessern und den Blutdruck zu stabilisieren.
Bei einer VV-ECMO-Therapie wird vereinfacht gesagt „nur“ die Lungenfunktion ersetzt. Das Herz muss also noch ausreichend kräftig schlagen um eine Blut-Zirkulation zu gewährleisten. Erhöht man in dieser Situation den Blutfluss bedeutet das, dass man dadurch zwar die Oxygenierung verbessert, nicht aber die Blut-Zirkulation. Eine Herz-Druck-Massage ist also obligat. Sofern eine Hypoxämie vorliegt ist der Blutfluss zu erhöhen. Erniedrigen würde ich den Blutfluss, sofern die ECMO ohne Probleme läuft nicht.
Generell gilt:
Saugen sich die Katheter fest, deutet vieles auf einen Volumenmangel hin und besonders in der Notfallsituation ist die Gabe von Flüssigkeit indiziert. Hierbei sollte man natürlich beachten, dass man bei der Gabe von größeren Mengen Vollelektrolytlösung eine Verdünnung der Blutzusammensetzung erreicht und deshalb auch die Gabe von EKs und FFPs oder bei Notwendigkeit auch TKs in Erwägung zieht.
Wenn sich der Katheter festsaugt, kann kurzfristig der Blutfluss reduziert werden, um diesen direkt danach wieder zu erhöhen.
Sofern das Herz wieder zu pumpen beginnt kann es post-reanimationem sinnvoll sein den Fluss der VA-ECMO zu reduzieren, um die konkurrierenden Flüsse zu minimieren.
Und es sollte auch klar sein, dass bei einer kreislaufrelevanten Herzbeuteltamponade nur die chirurgische Intervention zum Erfolg führt, ganz unabhängig der eingestellten ECMO-Flüsse.
Nun zu deiner zweiten Frage bezüglich des Cytosorb-Filters:
Ich persönlich habe den Einsatz eines Cytosorb-Filters bisher nur wenige Male auf der Intensivstation gesehen und habe dazu kaum Expertise.
Sofern aber eine Hämofiltration mit Cytosorb-Filter am Patienten angeschlossen sein sollte, würde ich zumindest den Entzug in der Notfallsituation reduzieren bzw. beenden.
Im ECMO-Kreislauf selbst habe ich bisher noch keine Zwischenschaltung eines Cytosorb-Filters gesehen, weshalb ich diese Frage nicht beantworten kann.
Ich hoffe dennoch, dass Du mit meiner Antwort etwas anfangen kannst.
Sofern es jemanden gibt, der die Cytosorb-Frage beantworten kann oder Anmerkungen zu meinen Überlegungen hat, freue ich mich natürlich sehr über etwaige Rückmeldungen.
Ein Paper zur ECMO und Cytosorb habe ich dazu gefunden:
Akil A, et al. Combined Use of CytoSorb and ECMO in Patients with Severe Pneumogenic Sepsis. Thorac Cardiovasc Surg. 2021 Apr;69(3):246-251. doi: 10.1055/s-0040-1708479. Epub 2020 Apr 6. PMID: 32252114.
Herzliche Grüße von den Pin-up-docs,
Dana
Hallo! Vielen lieben Dank für die ausführliche Antwort.
Die Situation war folgende.
Der Pat. hatte eine Pneumonie, welche mittels vv-ecmo versorgt wurde. Zusätzlich hat unser Cardiotechniker bei diesem Patienten einen Cytosorb Filter dazwischen geschaltet. Bei steigenden Infektwerten und steigenden Katecholaminen.
Der Pat. hatte eine Asystolie und wurde dann unter laufenden vv-Ecmo reanimiert.
Aber besten Dank für ausfuehrliche Antwort.
Ich habe mich heute nochmals mit unserem Kardiotechniker unterhalten, da der Cytosorbfilter als kleiner Kreislauf dazwischen geschaltet wurde und ein hohes Shuntvolumen hat empfiehlt er diesen für die Reanimationssituation auszuklingen.
Pingback: "titriert" ECMO - pin-up-docs - don't panic
Zum Thema Argatroban: Die empfohlene Dosierung für kritisch kranke für den Therapiebeginn ist 0.5µ/kg/min! Für nicht kritisch kranke werden lt. Hersteller 2µg/kg/min (sic!) empfohlen.
Meine Erfahrungen decken sich aber mit Euren, ich beginne meistens mit 0.25µg/kg/min, dann PTT nach 2h, dann Anpassung. Und was soll ich sagen: kann mich nicht erinnern, jemals nach der Kontrolle die Laufrate erhöht zu haben…
Vielen Dank für diesen tollen Beitrag und Euren großartigen Podcast!
Hey Jacob, vielen Dank für deinen Kommentar. Bei uns laufen zT sehr hohe Argatroban-Dosierungen vor allem bei Covid-Patienten.. Da musste ich des öfteren schon die Laufrate nach oben anpassen. Aber bei den „normal“ septischen ist das scheinbar seltener.
Herzliche Grüße, Dana
Pingback: ECMO by Dana Maria Spies (pin-up docs) – Critical Care Skills
Hallo Dana,
ich habe den Podcast gehört und mir jetzt noch deinen Artikel angelesen – vielen Dank für diese Arbeit!! Ich bin gespannt, was du uns noch bietest. Ich bin zwar nur Rettungssani, seit einigen Jahren altersbedingt nicht mehr aktiv auf Rädern unterwegs, deshalb klärt das auch bei mir etliche technische black holes.
Moin Holger,
das freut mich und uns sehr zu hören, dass Dir der Beitrag gefällt! Vielen Dank für die Rückmeldung und liebe Grüße,
Dana von den Pin-up-docs 🙂
Hallo Dana,
vielen Dank für die tolle Übersicht. Hast du Erfahrung zum Thema vv- ECMO und Bauchlage. Wann sollte denn eine Bauchlage in Erwägung gezogen werden und gibt es spezielle Dinge zu beachten sind bei ECMO und Bauchlage?
Liebe Grüße
Salomo
Hallo Salomo,
vielen Dank für deine Rückmeldung!
Wir machen auch mit einliegender vv-ECMO Bauchlage, hierbei ist natürlich auf eine gute Lagerung der Kanülen zu achten.
Die Indikation ist auch hier meines Erachtens das ARDS und die Möglichkeit der Verbesserung der Oxygenierung.
Hier drei Veröffentlichungen dazu, welche vielleicht ein bisschen Licht ins Dunkle bringen. So bekommst Du auch nicht nur Angaben, die eminenzbasiert sind 😉
1.)
Giani M, Martucci G, Madotto F, Belliato M, Fanelli V, Garofalo E, Forlini C, Lucchini A, Panarello G, Bottino N, Zanella A, Fossi F, Lissoni A, Peroni N, Brazzi L, Bellani G, Navalesi P, Arcadipane A, Pesenti A, Foti G, Grasselli G. Prone Positioning during Venovenous Extracorporeal Membrane Oxygenation in Acute Respiratory Distress Syndrome. A Multicenter Cohort Study and Propensity-matched Analysis. Ann Am Thorac Soc. 2021 Mar;18(3):495-501. doi: 10.1513/AnnalsATS.202006-625OC. PMID: 32941739.
und:
2.)
https://ccforum.biomedcentral.com/articles/10.1186/s13054-021-03675-6
sowie (leider hinter einer Paywall)
3.)
„Bauchlagerung von Patienten an der venovenösen ECMO ist möglich und sicher“
doi:10.1007/s00101-015-0131-6
Ich wünsche Dir noch eine schöne restliche Woche und hoffe sehr, dass ich Dir damit schon etwas helfen konnte. 🙂
Liebe Grüße von den Pin-up-docs,
Dana
Hallo Dana,
vielen Dank für deine Antwort. Das hilft weiter.
Gruß Salomo
Hallo zusammen,
Kann es auch aus irgendeinem Grund passieren, das sich die Kanülen, die ja angenäht sind ohne menschlichen Einfluss raus flutschen können ?
Hallo Kai,
sag niemals nie in der Medizin.. Also ganz theoretisch könnte das vielleicht passieren, mir ist ein solcher Fall aber bisher nicht bekannt. Genau dafür werden die Kanülen ja angenäht und so gesichert.
Lieben Gruß von den pin-up-docs,
Dana
Ok danke für die schnelle Antwort. Genau dieser Fall ist bei uns eingetroffen und die Begründung dafür lag wohl daran, das die sehr schmale Kanüle unerklärlicher weise durch den Druck/Reibung wie auch immer sich löste. Man hofft ja auf das gesagte der Mediziner. Unser Kind musste dann zwangsläufig reanimiert werden.
Lieber Kai, das klingt nach einer sehr anstrengenden Zeit für Euch alle! Sich diese Situation vorzustellen überschreitet schon das, was man überhaupt ertragen kann! Dafür wünsche ich Euch allen – vor allem aber dem Kind – ganz viel Kraft, Durchhaltevermögen und natürlich alles Gute und gute Besserung.
Zum fachlichen: Bei langfristiger Sedierung kann es zu einem abrupten und ungezielten Aufwachen mit sehr viel Bewegung kommen. Möglicherweise ist die Dekanülierung so entstanden. Da ich aber natürlich den Kasus nicht kenne, kann ich nur Vermutungen anstellen und auch das macht die Situation nicht ungeschehen!
Ich hoffe für Euch aber von Herzen, dass ein „normales“ Leben irgendwann möglich sein wird!
Fühlt Euch unbekannterweise umarmt, wenn ihr möchtet.
Dana
Hallo Dana,
ich habe eine Frage zum Flowmeter. Ganz links stelle ich den Gasfluss ein, ganz rechts die O2-Kontentration, z.B. 40%, das ist mir klar. Aber für was ist dann der o2-Regler in der Mitte? Kann ich den einfach aufdrehen, wie ich will und der Mischer nimmt sich so viel O2, wie er eben benötigt? Oder für was ist der da?
Viele Grüße
Judith
Hallo Judith,
du hast vollkommen recht mit deiner Aufteilung.
Man kann es auf den Bildern allerdings etwas schlecht erkennen: Beide linken Flowmeter beziehen sich auf den Gasfluss.
Ganz links in ml und dann folgt der mittlere Regler, der nach oben steigt, wenn man mehr als einen Liter aufdreht in L O2/min.
Es ist also eine zusammenhängende Scala zur Feinjustierung im ml-Bereich bis 1 L Gasfluss. 🙂
Ich hoffe das klärt deine Frage.
Lieben Gruß,
Dana