High Flow Nasal Cannula (HFNC) – respiratorisches Versagen neu gedacht ?

Schaut man 10 Jahre zurück gab es beim respiratorischen Versagen bei Intensivpatienten nur zwei Optionen: nicht-invasive oder invasive Beatmung. Hier hat in den letzten Jahren ein deutliches Umdenken stattgefunden, immer öfter trifft man bei Intensivpatienten auf die High Flow Nasal Cannula (HFNC) als Ersatz für die NIV-Beatmung. Welches hierfür die richtigen Indikationen sind, wie HFNC funktioniert und ob es immer Mittel der ersten Wahl sein sollte wollen wir im Folgenden beleuchten.
Wie funktioniert HFNC eigentlich ?
Die HFNC ist ein System, welches über eine Nasenkanüle ein definiertes Gemisch aus reinem Sauerstoff und Raumluft an den Patienten abgibt. Diese Abgabe erfolgt über einen Luft- /O2-Mischer und mit sehr hohen Flussraten von bis zu 60 l O2/min.
Über das System kann ein FiO2 von bis zu 1,0 erreicht werden und dies mit fast absoluter Konstanz, da der Sauerstoffflow deutlich über dem Atemminutenvolumen des Patienten liegt.
Wenn nun die nasale Kanüle entsprechend dicht in der Nase des Patienten sitzt, atmet dieser wirklich nur das Gasgemisch, das aus dem HFNC-Gerät bei ihm ankommt und man erreicht eine entsprechend hohe O2-Konzentration.
Auch wird durch die hohen Gasflüsse ein PEEP generiert. Dieser erreicht allerdings weder die Ausmaße der NIV, noch ist er direkt am Gerät einstellbar. Vielmehr hängt das erreichte PEEP-Niveau davon ab, ob der Patient den Mund offen oder geschlossen hält. Bei geschlossenem Mund sind PEEP-Werte von bis zu 2,7 cm H2O erreichbar, bei offenem Mund hingegen nur noch 1,2 cm H2O (Parke R, 2009). Wie realistisch beim durchschnittlichen Intensivpatienten die Compliance ist, die HFNC mit geschlossenem Mund zu tolerieren, muss jeder für sich selbst entscheiden.
Des Weiteren führt die Anwendung von HFNC zu einer effizienteren Atemarbeit, da der anatomische Totraum minimiert wird (Anreicherung des Atemgases mit Sauerstoff) und der Atemwegswiderstand durch den externen Gasfluss abnimmt. (Mauri T, 2017)
Weiterhin wird durch die Erwärmung und Anfeuchtung des inspiratorischen Gasgemisches im HFNC-Gerät die mukoziliäre Clearance verstärkt und darüber die pulmonale Belüftung verbessert, was wiederum zu einem verbesserten Ventilations-Perfusions-Verhältnis führt. (Simon, 2017)
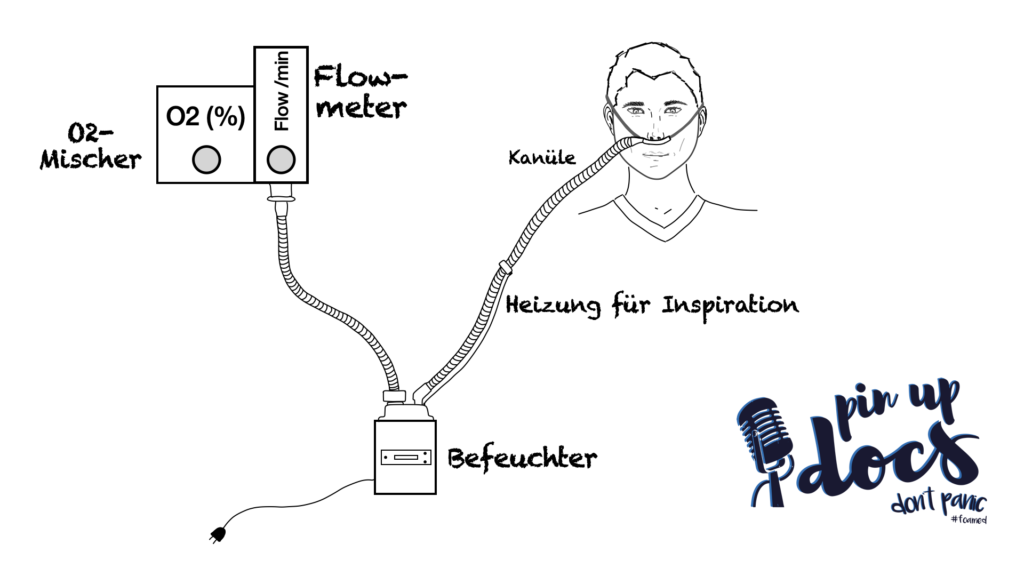
Aufbau eines HFNC-Geräts
Für welchen Patienten ist HFNC geeignet ?
Nach oben beschriebenen Thesen zur Wirkungsweise sollte HFNC vor allem bei Patienten mit einer akuten hypoxischen Insuffizienz eingesetzt werden. Für die Applikation bei exazerbierter COPD bzw. der akuten hyperkapnischen Insuffizienz finden sich allerdings kaum belegbare Daten, auch wenn die Anwendung von HFNC aufgrund der Generierung von PEEP theoretisch Sinn ergeben könnte. Daher können wir für die hyperkapnische Insuffizienz hier eine Empfehlung aussprechen.
Andere Indikationen ergeben sich für Patienten in der direkten Phase nach Extubation. Oft wurde hier in der Vergangenheit nicht-invasive-Beatmung (NIV) zur Anwendung gebracht, welche gerade bei deliranten Patienten oft schlecht toleriert wurde und so eine Re-Intubation notwendig wurde. Hier zeigen sich in der Literatur moderate Hinweise, dass durch die frühzeitige Anwendung von HFNC eine respiratorische Stabilisierung der Patienten zu erreichen ist, allerdings gibt es keinen Hinweis auf niedrigere Re-Intubationsraten.
Anders sieht die Empfehlung aus, wenn die Extubation nur erfolgt um den Patienten danach weiter mit NIV zu therapieren. Hier sollte dann auch konsequent NIV genutzt werden, ein Versuch mit HFNC erscheint nach vorliegenden Daten sinnlos.
Des Weiteren ist die Anwendung im direkten perioperativen Setting möglich. So zeigen sich moderate Hinweise, dass kardio-/thorax-chirurgische Patienten von einer präventiven Nutzung von HFNC profitieren. Hier konnte eine Senkung der Rate an respiratorischem Versagen gezeigt werden.
Auch im palliativen Ansatz kann ggf. über HFNC nachgedacht werden, wenn beispielsweise eine DNI-Order durch den Patienten besteht, aber Zeit überbrückt werden soll, um Abschied zu nehmen oder Ähnliches. Auch zur Linderung der Dyspnoe kann HFNC effektiv bei Palliativpatienten eingesetzt werden, wie aktuelle Daten zeigen (Ruangsomboon, 2020).
Das kardiale Lungenödem als Indikation zur HFNC-Therapie gerade im Vergleich zur etablierten NIV wurde auch wiederholt diskutiert. Akzeptable Studien zu genau dieser Fragestellung stehen noch aus. In einer kleinen Studie aus Südkorea konnte eine Symptomverbesserung bei der Nutzung von HFNC gezeigt werden, allerdings nur im Vergleich zur konventionellen Sauerstoffapplikation (also nur leichte/moderate Lungenödeme in Studie) (Ko, 2020). Daher lässt sich bisher keine Empfehlung zur Indikation von HFNC beim kardialen Lungenödem aussprechen.
Zusammengefasst also noch einmal die Indikationen für HFNC (Rochwerg, 2020):
- Akutes respiratorisches Versagen (Hyperkapnie = NIV bevorzugen)
- Direkt post-extubationem (schwache Empfehlung)
- Ggf. präventiv bei kardio- bzw. thoraxchirurgischen Patienten
Bringt HFNC einen Überlebensvorteil ?
Tatsächlich konnte in Studien ein Überlebensvorteil für Patienten mit akuter hypoxämischer respiratorischer Insuffizienz im 90-Tage-Intervall gezeigt werden (Frat, 2015). Dies gilt im Vergleich mit Sauerstoff-Inhalation aber spannenderweise auch im Vergleich mit NIV.
Entscheidend ist hierbei jedoch die Indikationsstellung.
Wie es zu diesem Überlebensvorteil kommt lässt sich sowohl aus den physiologischen Überlegungen, die zu Beginn dieses Artikels angestellt wurden, als auch aus Studien ableiten.
So verbessert sich durch die Anwendung von HFNC nicht nur die Oxygenierung, sondern es kommt auch zu einer Reduktion von Atem- und Herzfrequenz sowie der thorako-abdominellen Asynchronizität. Auch einfache Dyspnoe-Scores werden verringert. (Sztrymf, 2011)
Mit Hilfe eines neuen Index, der Atemfrequenz und Oxygenierung unter HFNC miteinander vergleicht, lässt sich nun auch eine Aussage über die Wahrscheinlichkeit einer notwendigen Intubation unter HFNC treffen. Hierzu werden Quotienten aus oben genannten Parametern gebildet und nach 2, 6 und 12 Stunden unter HFNC miteinander verglichen (ROX-Index). Die Oxygenierung hat hierbei für ein Versagen der HFNC-Therapie einen höheren prädiktiven Wert als die Atemfrequenz (Roca, 2019).
Entscheidend für die Prognose unter HFNC ist eben vordergründig auch, das mögliche Versagen zu erkennen und die ggf. notwendige Intubation nicht herauszuzögern, da dies mit einem schlechteren Outcome im ARDS assoziiert ist. Hier kann der Score von Roca et al einen wertvollen Beitrag leisten.
Ähnliche Diskussionen kennen wir aus den Intubationsentscheidungen bei Covid-Pneumonien. Auch hier scheint der richtige Zeitpunkt der Intubation nach wie vor ein wichtiger Prädiktor zu sein (Kang, 2015).
Und wie macht man HFNC jetzt praktisch ?
Die Indikationen für die HFNC haben wir weiter oben schon ausführlich besprochen. In unserem klinischen Alltag nutzen wir HFNC vor allem bei Patienten mit hypoxämischer respiratorischer Insuffizienz, d.h. bei Patienten mit Pneumonie, mildem ARDS im Rahmen der Sepsis oder ähnlichen Indikationen.
Starre Grenzwerte im Rahmen eines bestimmten Oxygenierungsindex halten wir für relativ weit hergeholt. Für uns liegt die Entscheidung nahe, auf HFNC zu wechseln, wenn sich mit normaler O2-Insufflation keine Stabilisierung des SpO2 erreicht lässt (kontinuierlich unter 92% SpO2 bei 8-10 l/O2/min).
Auch mit der normalen O2-Nasenbrille bzw. O2-Maske mit Reservoir lassen sich hohe FiO2-Level erreichen, wenn man sehr hohe O2-Flussraten (≥ 15 l/min) wählt, dies ist aber unangenehm, da hier die Einatemluft weder befeuchtet noch angewärmt wird (Farkas, 2019). Daher sollte bei solchen „MacGyver“-Techniken möglichst schnell auf die echte HFNC gewechselt werden.
Wir müssen uns also entscheiden zwischen HFNC, NIV oder sogar einer Intubation.
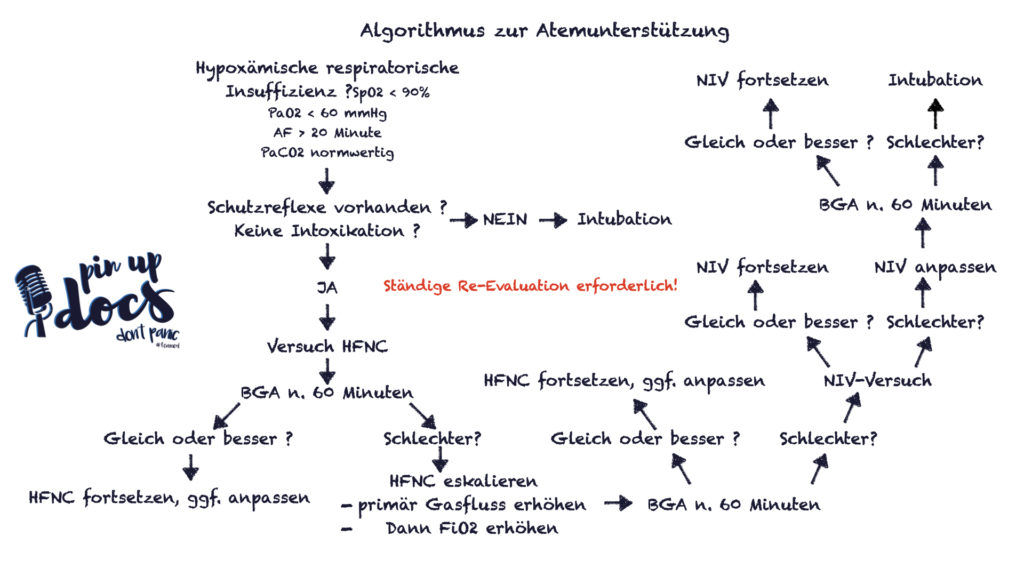
Die Intubation wird konsequenterweise primär durchgeführt, wenn der Patient bewusstlos ist, also über keine Schutzreflexe verfügt (keine NIV versuchen!).
Bei primär hypoxämischer Insuffizienz empfehlen wir einen HFNC-Versuch unter ständiger Reevaluation. Hierbei halten wir insbesondere eine engmaschige Beurteilung des klinischen Verlaufes unter der Maßnahme für essenziell: Beruhigt sich die Atemfrequenz? Ist der Patient entspannt? Ist die Atemmechanik adäquat? Verändert sich die SpO2? In unserem Vorgehen hat sich darüber hinaus eine arterielle BGA alle 60 Minuten bewährt. Verschlechtert sich die respiratorische Insuffizienz weiter, so hat der Patient den Versuch der NIV verdient. Lässt sich auch hierunter keine Stabilisierung erreichen oder wird die NIV nicht toleriert, so ist der Patient konsequenterweise zu intubieren – es sei denn, es liegt eine DNI-Order vor.
HFNC – Schritt für Schritt
Die Entscheidung für HFNC ist gefallen, jetzt also „Butter bei die Fische“:
Step 1 – Aufbauen des Systems
Mit viel Glück habt ihr hier tatkräftige Unterstützung. Aber ihr solltet trotzdem ein paar Dinge wissen.
Jedes HFNC-Gerät hat eine Befeuchterkammer, durch diese wird das O2-/Luftgemisch geleitet, d.h. hier muss es einen Zu- und einen Ableitungsschenkel geben.
Der O2-/Luft-Mischer muss an der Wand am Sauerstoffanschluss angeschlossen sein, sonst gibt es logischerweise keinen Sauerstoff für den Patienten.
Die Wärmeplatte muss an den Strom angeschlossen sein (aber keine Sorge, sonst funktioniert das gesamte Gerät nicht).
Bevor man das Gerät anschließt sollte das Gasgemisch vorgewärmt sein, damit der Patient nicht der Gefahr einer Bronchokonstriktion ausgesetzt wird. In der Regel wird das Gasgemisch auf 37 °C aufgewärmt und hat eine relative Luftfeuchtigkeit von 100 % um die mukoziliäre Clearance zu verbessern und die Sekretmobilisation zu erleichtern (Wachs, 2020).
Der Patient muss eine HFNC-Kanüle passender Größe der in der Nase haben, sodass die Nasenlöcher gut abgedichtet sind (andere Quellen wiederum geben an, dass die Kanüle maximal 50 % des Nasenloches abdichten soll). Zusammenfassend kann man hier wohl sagen, dass die Kanüle für den Patienten angenehm zu tragen sein soll.
Die Befeuchterkammer sollte niemals oberhalb des Patientenniveaus angebracht werden, da sich sonst Kondenswasser in den Schläuchen sammelt, welches dann entweder in die Nase des Patienten transportiert werden kann oder auch als Reservoir für eine mögliche Keimbesiedlung dient (sogenannte „Pfützenkeime“ → besonders Pseudomonaden).
Step 2 – Erste Einstellungen
Wenn die HFNC-Kanüle erstmal sicher in der Nase des Patienten sitzt gibt es gar nicht mehr viele Möglichkeiten zum Einstellen – es bleiben noch der Gasfluss und die FiO2.
Normale HFNC-Geräte können einen Gasfluss bis zu 60 Liter pro Minute generieren und die FiO2 kann zwischen 21 und 100 % eingestellt werden.
Wir starten mit einem Gasfluss von 30-35 l/min und einer FiO2 von 40 %.
Es ist sinnvoll im Verlauf primär den Gasfluss zu steigern, um die physiologischen Vorteile des Verfahrens zu nutzen und FiO2 zu „sparen“.
Im Folgenden sollte engmaschig der Erfolg der Therapie evaluiert werden. Hierzu ist nicht alleine die arterielle Blutgasanalyse (aBGA) heranzuziehen. Auch klinische Faktoren wie Atemfrequenz, SpO2 und subjektives Empfinden des Patienten sind zu berücksichtigen.
Zeigt sich bei den Kontrollen keine Verbesserung der Oxygenierungssituation, so ist die HFNC anzupassen und ggf. das Verfahren zu wechseln.
Step 3 – Weaning
Hier ist es schwierig eine eindeutige Empfehlung abzugeben. Nach (Farkas, IBCC, 2019) kann das Weaning begonnen werden, wenn der Patient unter einer FiO2 von 50 % und 20 l/min Gasfluss eine stabile Oxygenierung zeigt.
Es sollte dann auf eine Nasenbrille mit 6 l/min O2 umgestellt werden, etwa entsprechend einer FiO2 von 40 bis 50 %.
Exkurs: HFNC & CoViD
Zu Beginn der CoViD19-Pandemie wurde, auch von uns, die frühzeitige Intubation der Patienten propagiert. Dies hat sich in den letzten Monaten gewandelt, eher hin zu Formen der nicht-invasiven-Beatmung.
Auch HFNC hat hier einen großen Stellenwert, da es sich bei den pulmonalen Komplikationen der CoViD-Infektion ja vor allem um ein hypoxämisches Lungenversagen im Rahmen einer viralen Pneumonie handelt.
Von großer Wichtigkeit ist hierbei die Frage der Aerosolbildung. Entscheidend ist hierbei der korrekte Sitz der Kanüle. Sitzt diese dicht, so ist die Aerosolwolke geringer ausgeprägt als bei konventioneller Sauerstoff-Applikation (Hui, 2019).
Auch kann die Aerosolbildung bei Tragen eines medizinischen Mund-Nasen-Schutzes über der nasalen Kanüle um bis zu 80 % reduziert werden (Leonard, 2020). Natürlich sollte die persönliche Schutzausrüstung des betreuenden Personals trotzdem komplett getragen werden und es darf auf keinen Fall eine notwendige Intubation unter HFNC verzögert werden.
Punchlines
- Hauptindikation von HFNC ist die akute hypoxämische respiratorische Insuffizenz
- HFNC generiert PEEP
- Erst Flow erhöhen, dann FiO2 anpassen
- Die Nutzung von HNFC darf eine notwendige Intubation nicht verzögern
- Bei korrekter Indikation ggf. Überlebensvorteil
- Auch bei CoViD19-Infektionen in Verbindungen mit Mund-Nasen-Schutz sicher

Downloads:
Autoren
Dr. med. Thorben Doll
Arzt in Weiterbildung Anästhesiologie, aktiver Notarzt, lernte die Notfallmedizin von der Pike auf kennen, präklinische Erfahrung 17 Jahre und Gründer von Pin-Up- Docs.de
Johannes Pott
Arzt in Weiterbildung Anästhesiologie, aktiver Notarzt, Lieblingsbaustelle ist die Intensivstation. Seit 16 Jahren im Rettungsdienst und Gründer von Pin-Up-Docs.de
Literaturverzeichnis
Farkas. (2019). IBCC. Von Internet Book of Critical Care: https://emcrit.org/ibcc/support/#overall_guide_to_choosing_modality abgerufen 17.05.2021
Farkas. (2019). Noninvasive Respiratory Support . IBCC, S. https://emcrit.org/ibcc/support/#indications_for_HFNC. abgerufen 17.05.2021
Frat. (372 2015). High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure. New England Journal of Medicine, S. 2185-2196.
Hui. (135 2019). Exhaled air and aerosolized droplet dispersion during application of a jet nebulizer. Chest, S. 648-654.
Kang. (April 2015). Failure of high-flow nasal cannula therapy may delay intubation and increase mortality. . Intensive Care Medicine, S. 623-632.
Ko. (June 2020). Benefits of High-Flow Nasal Cannula Therapy for Acute Pulmonary Edema in Patients with Heart Failure in the Emergency Department: A Prospective Multi-Center Randomized Controlled Trial. Journal of clinical medicine.
Leonard. (April 2020). Preliminary Findings on Control of Dispersion of Aerosols and Droplets During High-Velocity Nasal Insufflation Therapy Using a Simple Surgical Mask Implications for the High-Flow Nasal Cannula. Chest, S. 1046-1049.
Mauri T, T. C. (195 2017). Physiologic effects of high- flow nasal cannula in acute hypoxemic respiratory failure. American Journal of Respiratory Critical Care Medicine, S. 1207–1215.
Parke R, M. S. (103 2009). Nasal high-flow therapy delivers low level positive airway pressure. British Journal of Anasthesia, S. 886-890.
Roca. (June 2019). An index combining respiratory rate and oxygenation to predict outcome of nasal high flow therapy. American Journal of Respiratory and Critical Care Medicine, S. 1368-1376.
Rochwerg. (46 2020). The role for high flow nasal cannula as a respiratory support strategy in adults: a clinical practice guideline. Intensive Care Medicine, S. 2226-2237.
Ruangsomboon. (May 2020). High-Flow Nasal Cannula Versus Conventional Oxygen Therapy in Relieving Dyspnea in Emergency Palliative Patients With Do-Not-Intubate Status: A Randomized Crossover Study. Annals of Emergency Medicine, S. 615-626.
Simon, G. K. (13 2017). High-Flow-Sauerstofftherapie in der Intensivmedizin. Intensivmedizin up2date, S. 259-269.
Sztrymf. (37 2011). Beneficial effects of hu- midified high flow nasal oxygen in critical care patients: a pro- spective pilot study. Intensive Care Medicine, S. 1780-1786.
Wachs. (145 2020). High-Flow-Sauerstofftherapie – Schritt für Schritt. Deutsche Medizinische Wochenschrift, S. 693-697.


Pingback: Podcast Mai 2021 - Folge 28 - pin-up-docs - don't panic
Pingback: "titriert" HFNC - pin-up-docs - don't panic