Inhalative Stickstoffmonoxid-Therapie

Einleitung:
Arbeitet man als Assistenzärztin oder Assistenzarzt auf einer Intensivstation, gibt es einige Therapien, die nicht auf Anhieb so geläufig sind. So erging es auch mir (Dana) zu Beginn meiner Intensivzeit mit der inhalativen NO-Therapie.
In diesem Artikel möchten wir Euch daher die NO-Beatmung beziehungsweise inhalative NO-Therapie näher bringen.
Und auch, wenn die Therapie oft bei sehr kranken PatientInnen zum Einsatz kommt, zählt wie immer „don’t panic“.
Entdeckung und Eigenschaften:
NO (Stickstoffmonoxid) ist ein geruch- und farbloses inertes Gas mit einer Dichte von 1,34 g/l. Es entsteht unter anderem als unerwünschter Nebeneffekt bei Verbrennungsvorgängen, Zigarettenrauch und Autoabgasen – wobei vor allem NO2 als Umweltproblemstoff bekannt ist. Die Herstellung bzw. medizinische Aufbereitung und somit auch die Applikation an PatientInnen ist sehr kostspielig. Daher wird diese Therapie meistens an größeren Krankenhäusern durchgeführt. Die Einheit, in der Stickstoffmonoxid verabreicht wird, ist „parts per million“ = ppm. (1 ppm NO entspricht 1 mm3 NO in einem Liter)
Die Entdeckung in den 1970 Jahren erfolgte gleichermaßen durch mehrere Personen, weshalb für Stickstoffmonoxid auch der Name EDRF (endothelium derived relaxing factor) bekannt war. Es zeigte sich schon damals eine Wirkung auf glatte Muskelzellen, sodass dem NO Steuerungsfunktionen für Körperzellen zugeschrieben wurden.
Die drei federführenden Forscher, die als Entdecker der NO-Wirkung auf Körperzellen gelten, waren Robert F. Furchgott, Louis .J. Ignarro und Ferid Murad. Sie wurden 1998 mit dem Nobelpreis für Medizin ausgezeichnet.
Wirkmechanismus:
NO wirkt vor allem vasodilatatorisch und wird auch durch den Körper selbst für diesen Zweck synthetisiert. Es ist also ein Botenstoff der Endothelzellen, der mit Hilfe des Enzyms NO-Synthase aus der Aminosäure L-Arginin gebildet wird.
Die Wirkung des Stickstoffmonoxids erfolgt über Aktivierung der löslichen Guanylatzyklase, wodurch die Bildung von zyklischem Guanosinmonophosphat (cGMP) gefördert wird. Hierdurch wird eine Vasodilatation hervorgerufen, indem es die Muskelzellen relaxiert und somit den pulmonalarteriellen Widerstand senkt. Als weitere Folge sinkt auch der mittlere pulmonalarterielle Druck.
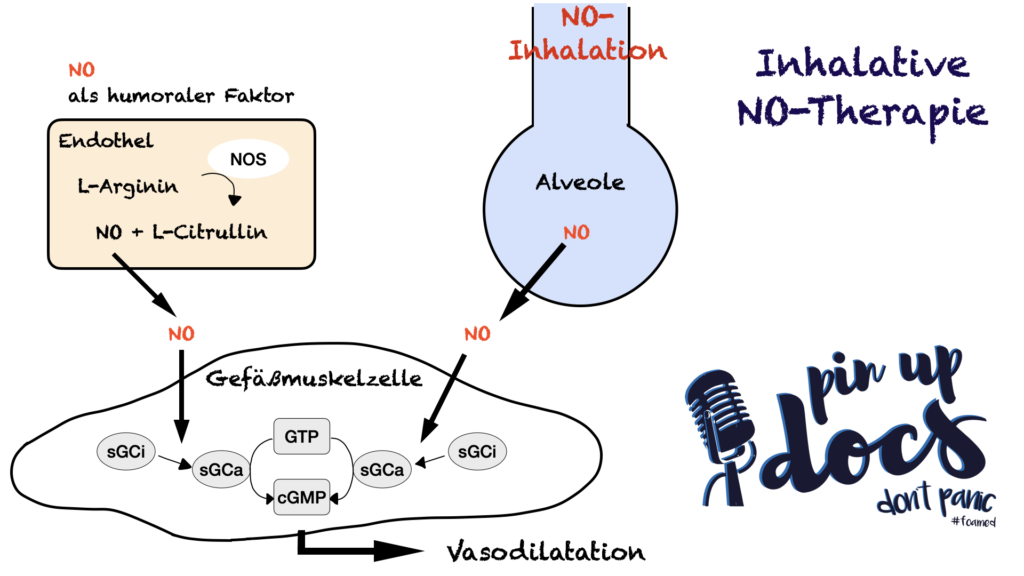
Bei einer lokalen Applikation wirkt NO selektiv vasodilatatorisch und verbessert somit das Ventilations-Perfusions-Verhältnis. Dies zeigt sich in der Regel auch in einer Verbesserung der Oxygenierung. Zusätzlich wird eine schwach bronchodilatatorische Wirkung beobachtet.
Vor allem bei einer systemischen Applikation von NO-Donatoren (z.B. Nitraten), kann der Rechts-Links-Shunt durch eine ungünstigere Verteilung von Ventilation und Perfusion auch vergrößert werden. Hierbei erfolgt eine unvorteilhaft vermehrte Durchblutung von schlechter belüfteten Arealen der Lunge, womit eine Vergrößerung des Rechts-Links-Shunts einhergehen kann.
Zusätzlich ist es möglich, dass bei einer systemischen Gabe der mittlere arterielle Druck (MAP) absinkt, was wiederum eine Verminderung der Organdurchblutung und eine Hypotonie zur Folge haben kann.
Durch die selektive Vasodilatation bei einer inhalativen Anwendung von Stickstoffmonoxid vermeiden wir aber dieses Problem größtenteils.
Stickstoffmonoxid wirkt hemmend auf die Thrombozytenaggregation ((1) und Dangel)
- Hier wird die Wirkung auf die Thrombozytenaggregation erklärt, deshalb Achtung! jetzt wird es biochemisch: NO führt über eine Stimulation der Guanylatcyclase zu einem Anstieg von cGMP und dadurch zu einer Aktivierung von weiteren Proteinkinasen. Diese Proteinkinasen wirken wiederum (über eine Phosphorylierung) aktivierend auf Effektorproteine (wie u.A. Vasodilator-stimulierendes Phosphoprotein (VASP) und Inositol-1,4,5-triphosphat-Rezeptorassoziiertes-cGMP-Kinase-Substrat (IRAG), Myosin-leichte-Kette-Phosphatase MLCP, Phospholamban (PLB)). Diese und weitere Substrate führen über den genannten Weg zu einer Thrombozytenaggregationshemmung. (Dangel)
Zudem hat Stickstoffmonoxid eine bakterizide Wirkung über die makrophagenabhängige Immunabwehr. (Aus: (1))
Eine Beeinflussung des Effekts einer iNO-Therapie durch Katecholamine wird nicht beschrieben.
Metabolismus:
- Die Wirkdauer von Stickstoffmonoxid beträgt nur wenige Sekunden, was in der kurzen Halbwertszeit von 4-8 Sekunden begründet ist.
- Im Körper oxidiert NO mit O2 zu Stickstoffdioxid, welches sich dann in Nitrit (NO2) und Nitrat (NO3), sowie Wasserstoff (H2) aufspaltet.
- Zusätzlich wird im Körper NO rasch durch Hämoglobin inaktiviert, wobei NOHb entsteht, das dann zu Methämoglobin oxidiert und daraufhin wieder zu freiem Hb regeneriert wird.
- Als Endprodukte fallen NO3, HNO3 und HNO2 aus. Die beiden Letzteren können in höheren Konzentrationen ätzend auf das Lungenparenchym wirken und zu einem toxischen Lungenödem führen.
Folgende Nebenwirkungen können sich ergeben:
- Ein Nierenversagen aufgrund der iNO-Therapie wird diskutiert.
- In folgenden Studien wurde ein Nierenversagens im Zusammenhang mit einer NO-Therapie beschrieben: Adhikari NK, Afshari A, Gebistorf F.
- In diesen Studien wurde eine NO-Therapie nicht als aus Auslöser für ein Nierenversagen angesehen: Yu B, Lei C, Valdivielso JM.
- Eine einheitliche Meinung herrscht hier also nicht. Spezielle Werte zur Bestimmung der Nierenfunktion unter NO-Therapie wurden, in den diesem Artikel zugrundeliegenden Studien nicht genannt.
- Der Methämoglobinspiegel kann erhöht sein (Antidot: Methylenblau und Ascorbinsäure (Vit C)).
- Gerinnungskomplikationen sind aufgrund der o.g. Thrombozytenaggregationshemmung möglich.
- Es kann sich ein toxisches Lungenödem bei hohen Dosierungen zeigen. (Bei Dosierungen < 50 ppm wurde das in der Literatur eher nicht beschrieben.)
Anwendung und Indikationen:
Voraussetzung für eine iNO-Therapie ist eine generell ausreichende Ventilation. Gegebenenfalls ist eine Beatmungsoptimierung vor der Initiation der iNO-Therapie indiziert.
Bei folgenden Erkrankungen kann eine inhalative NO-Therapie angewendet werden:
- ARDS,
- pulmonale Hypertonie (mit Remodeling = Umbauveränderungen der Lunge, die den pulmonalvaskulären Widerstand erhöhen),
- PPNH pulmonale Hypertonie bei Neonaten,
- Rechtsherzinsuffizienz ohne pulmonale Hypertonie (RVEF < 30%), bzw. akutes Rechtsherzversagen,
- Perioperatives Ischämie-/Reperfusionssyndrom nach Lungentransplantation,
- Sichelzellanämie (mittels einer Veränderung der pulmonalen Zirkulation, wird eine Optimierung der Oxygenierung erreicht).
Wie könnten wir beurteilen, ob ein Patient oder eine Patientin von einer iNO-Therapie profitiert?
Eine echokardiografische Untersuchung ist zur Evaluation möglich: Geübte sind hierbei in der Lage, den pulmonalvaskulären Widerstand bzw. den rechtsventrikulären Druck abzuschätzen.
Exkurs: (aus Herold 2019)
pulmonale Hypertonie:
- chronische Erhöhung des PAPm (mittlerer Pulmonalarteriendrucks) in Ruhe ≥25 mmHg.
- Ursachen:
- durch Linksherzerkrankungen (Dysfunktionen oder Klappenerkrankungen),
- durch Lungenerkrankungen (COPD, interstitielle Lungenkrankheit, Schlafbezogene Atmungsstörungen, Höhenexposition),
- multifaktorielle Genese,
- Durch Remodeling = Umbauveränderungen erhöht sich der pulmonalvaskuläre Widerstand -> Rechtsherzbelastung -> Rechtsherzversagen.
- Ursachen:
pulmonal-arterielle Hypertonie
- PAPm ≥25 mmHg in Ruhe, pulmonal-arterieller Verschlussdruck (PAWP) ≤ 15 mmHg und pulmonal-vaskulärer Widerstand (PVR) > 240 dyn*s*cm-5
- Ursachen:
- idiopathisch,
- hereditär,
- Medikamenten-/Drogen-assoziiert,
- durch Bindegewebserkrankungen, HIV, portale Hypertension, u.A.
- Ursachen:
Kontraindikationen: (1)
- Absolut:
- Methämoglobin-Reduktasemangel,
- Methämoglobinämie ≥ 5%.
- Relativ:
- intrakranielle Blutung,
- hämorrhagische Diathesen,
- schwere Linksherzinsuffizienz (aufgrund der Erhöhung der linksventrikulären Vorlast).
Allgemeine Informationen zur Anwendung:
NO wird üblicherweise in einer Dosierung zwischen 5 und 40 ppm appliziert. Eine Dosis von > 200 ppm wirkt zytotoxisch und eine Konzentration von 500-1000 ppm wird als letal beschrieben.
In der Größenordnung von 5-40 ppm ist eine besondere exspiratorische Gasabsaugung nicht zwingend notwendig, es wird aber ein Injektormodul für das Gas, sowie einen Befeuchtertopf, der hinter dem Injektormodul angeschlossen wird, benötigt.
Hierbei gilt der Merksatz: „iNO geht durch das Wasser“.
Es besteht selbstverständlich die Notwendigkeit einer adäquaten Überwachung. Eine Messung der verabreichten ppm ist natürlich gewünscht, allerdings leider zum Teil fehlerhaft (da die eingestellten ppm nicht immer den applizierten ppm entsprechen).
Möchte man synergistische Effekte nutzen, so kann man vorher noch ein Recruitment-Manöver durchführen, um sowohl physikalisch (mehr belüftete Lungenabschnitte) als auch mit besserem Ventilations-Perfusions-Verhältnis (NO) die Oxygenierung zu verbessern.
Nach dem initialen Anschluss kann es zu einem Blutdruckabfall durch die Vasodilation kommen. Zusätzliche Recruitment-Mannover können hämodynamisch relevant werden, weshalb eine genaue Indikationsstellung zwingend notwendig ist.
NO-Responder vs. NO-Non-Responder: (1)
Die Erfolgsquote beläuft sich nur auf 60%. Man sieht aber meist frühzeitig, ob die Therapie anschlägt oder nicht. In diesem Zusammenhang wird diskutiert, ob die Veränderung des Ventilations-Perfusions-Verhältnisses bei einer pulmonalen Hypertonie dazu beiträgt, dass das Shuntvolumen zunimmt, und somit schlecht ventilierte Bereiche nun besser perfundiert werden, was das Vorkommen von NO-Non-Respondern erklären würde. Einige PatientInnen reagieren auch paradox auf NO mit einer akuten Verschlechterung durch eine Erhöhung des mPAP und PCWP.
NO-Responder zeigen eine Verbesserung der Oxygenierung im Sinne einer Zunahme des PaO2/FiO2-Quotienten um ≥ 20% bzw. eine Abnahme der erhöhten Pulmonalisdrücke mit einer Abnahme des PAP um ≥ 20%.
Weitere Erfolgskriterien sind eine Zunahme der rechtsventrikulären Ejektionsfraktion um ≥ 10% und einer Erhöhung der gemischt-venösen Sauerstoffsättigung (svO2) um ≥ 5%.
NO-Non-Responder sind in der Regel PatientInnen mit einem normalen pulmonal-vaskulären Gefäßtonus oder solche, bei denen ein vaskuläres Remodeling im pulmonal-arteriellen Gefäßbett stattgefunden hat (z.B. wegen Mikrothromben, oder Initimafibrose).
Ein Gewöhnungseffekt im Sinne einer Tachyphylaxie konnte in einigen Studien nicht gezeigt werden, es wird aber darüber diskutiert, ob ein Gewöhnungseffekt bestehen könnte, da andere Studien diesen nahegelegt haben.
Beenden der Therapie bzw. Weaning:
Bei der Beendigung der Therapie ist darauf zu achten, dass es nicht zu einem abrupten Absetzen des inhalativen NOs kommt, da sich Rebound-Effekte am ehesten infolge einer verstärkten Vasokonstriktion zeigen können. Diesem Effekt liegt ein Ungleichgewicht von endogenen Vasodilatatoren und -konstriktoren zugrunde, wobei die körpereigenen Vasokonstriktoren durch eine vorherige Supprimierung der endogenen NO-Synthase überwiegen (1).
Zur Reduktion bzw. dem Weaning der iNO-Therapie äußert sich C. Fremerey (allerdings im Bezug auf die neonatale Versorgung) folgendermaßen:
- Bei > 10 ppm soll eine Reduktion auf 10 ppm erfolgen, bei einem Sättigungsabfall > 2% können die Einstellungen wieder zurückgenommen werden,
- ab 10 ppm kann eine Reduktion in 1 (-2) ppm Schritten erfolgen,
- bei der weiteren Entwöhnung ist meist eine längere Phase mit niedriger NO-Zufuhr notwendig (Inaktivierung der endogenen NO-Synthase).
Dieses oder ein ähnliches Konzept ist auch für die Praxis bei erwachsenen PatientInnen ein gangbarer Weg.
Vorsichtsmaßnahmen:
Wichtig ist die (regelmäßige) Kontrolle folgender Parameter:
- Wegen der Entstehung von Nitraten und Nitriten sowie einem möglichen Nierenversagen durch NO sollten die Retentionsparamter überwacht werden.
- Regelmäßige Kontrolle von MetHb: Dieser soll <5% ((1)) des Gesamt-Hbs sein, (Normalwert: 0,2%).
- Die Gerinnung sollte regelmäßig kontrolliert und es muss auf etwaige Blutungskomplikationen geachtet werden.
- MAK-Werte ( = maximale Arbeitsplatzkonzentration): (1)
- NO: 25 ppm,
- NO2: 3 ppm.
Exkurs Methämoglobinintoxikation:
- Symptome einer Zyanose, Kopfschmerzen, Dyspnoe,
- schiefergraue Hautfarbe,
- Bewusstseinseintrübung, Krampfanfälle, Azidose,
- klinische Symptome meist erst ab einem MetHb von > 35% des Gesamt-Hbs,
- Zyanose ohne erkennbare pulmonale oder kardiale Ursache,
- Antidot: Methylenblau (1 mg/kgKG) oder Toluidinblau (2-4 mg /kgKG) und Ascorbinsäure i.v.
- CAVE: Nebenwirkung der Antidottherapie: Hämolyse.
Einsatz in der Kardiochirurgie:
Die Indikation für eine NO-Therapie in der Kardiochirurgie ist meist bei einem Rechtsherzversagen gegeben. Gerade im Rahmen einer Herztransplantation besteht häufig schon präoperativ ein erhöhter pulmonalarterieller Widerstand, der post-operativ nach der Transplantation das Spender-Herz belastet. Hier lässt sich eine iNO-Therapie zur Verminderung der Rechtsherzbelastung erwägen. Im Rahmen dieser Behandlung zeigten sich keine negativen Veränderungen des zentralvenösen Drucks (ZVD), des mittleren arteriellen Drucks (MAP), des systemischen Widerstands (SVR) oder des Cardiac Index (CI) – weshalb eine Anwendung in diesem Gebiet möglich ist.
Yu et al. beschreiben sogar bei pädiatrischen PatientInnen eine Verbesserung der Lungendurchblutung, dem systemischen Blutfluss und des Cardiac Outputs bei Einsatz in der pädiatrischen Kardiochirurgie.
Inhalative NO-Therapie im Rahmen einer Covid-19 Erkrankung (Riccardolo et al.)
Leider ist die Datenlage bisher zu diesem Aspekt der iNO-Therapie nicht sehr umfangreich. Eine kleine Übersichtsarbeit aus dem „Journal of Breath Research“ aus dem Dezember 2020 konnte aber erneut herausstellen, dass die Oxygenierung bei PatientInnen mit Hypoxämie durch eine iNO-Therapie mit 30 ppm verbessert werden kann.
Auch ein kurzer Stoß mit einer hohen Anzahl an ppm wurde unter Umständen als protektiv angegeben (siehe: Hedenstierna G, Chen L, Hedenstierna M, Lieberman R and Fine D H 2020 Nitric oxide dosed in short bursts at high concentrations may protect against Covid 19 Nitric Oxide 103 1–3). Hier ist allerdings zu beachten, dass diese Dosierungen in anderen Arbeiten als letal angesehen werden (Griffiths et al).
Fazit:
Die iNO-Therapie ist keine kausale, sondern immer nur eine „symptomatische“ Therapie, die einerseits zu einer vorübergehenden Besserung der Oxygenierung führen oder aber andererseits zu einer Verminderung der Rechtsherzbelastung beizutragen vermag. Es lässt sich also sagen, dass sich die Parameter des Gasaustauschs kurzfristig durch die iNO-Therapie durchaus verbessern können.
Eine Verbesserung des Outcomes oder einer Verminderung von Ventilator-freien Tagen konnte bislang aber noch nicht beobachtet werden (Gebistorf F). Es gibt allerdings Anhaltspunkte, dass durch den Einsatz einer NO-Beatmung häufiger eine ECMO-Therapie vermieden werden konnte (Monsalve-Naharro et al.). Eine Routine-Applikation sollte nicht stattfinden.
Sofern die Grunderkrankung nicht heilbar ist, muss der Einsatz einer iNO-Therapie kritisch zu hinterfragt werden.
Autorin:
Dana Maresa Spies, Assistenzärztin Anästhesie und Intensivmedizin
Vielen Dank an das Pin-up-docs-Team und meinen KollegInnen für die zahlreichen guten und weiterführenden Hinweise.
Quellen:
- (1) „Atmen – Atemhilfen“ – Oczenski, Wolfgang: 2008; DOI: 10.1055/b-002-21532; Online ISBN 9783131912480
- (2) „Beatmung mit Stickstoffmonoxid“ M. Sicksch; Intensiv 2006; 14(4): 186-190; DOI: 10.1055/s-2006-926913
- Herold „Innere Medizin“; 2019; ISBN: 978-3-9814660-8-9
- Klinikstandards für Neonatologie und pädiatrische Intensivmedizin (ISBN 9783131738219) C. Fremerey
- Rossaint R, Falke KJ, López F, Slama K, Pison U, Zapol WM. Inhaled nitric oxide for the adult respiratory distress syndrome. N Engl J Med. 1993 Feb 11;328(6):399-405. doi: 10.1056/NEJM199302113280605. PMID: 8357359.
- Ricciardolo FLM, Bertolini F, Carriero V, Högman M. Nitric oxide’s physiologic effects and potential as a therapeutic agent against COVID-19. J Breath Res. 2020 Dec 5;15(1):014001. doi: 10.1088/1752-7163/abc302. PMID: 33080582.
- Yu B, Ichinose F, Bloch DB, Zapol WM. Inhaled nitric oxide. Br J Pharmacol. 2019 Jan;176(2):246-255. doi: 10.1111/bph.14512. Epub 2018 Nov 16. PMID: 30288739; PMCID: PMC6295404.
- Monsalve-Naharro JÁ, Domingo-Chiva E, García Castillo S, Cuesta-Montero P, Jiménez-Vizuete JM. Inhaled nitric oxide in adult patients with acute respiratory distress syndrome. Farm Hosp. 2017 Mar 1;41(2):292-312. English. doi: 10.7399/fh.2017.41.2.10533. PMID: 28236803.
- Griffiths MJ, Evans TW. Inhaled nitric oxide therapy in adults. N Engl J Med. 2005 Dec 22;353(25):2683-95. doi: 10.1056/NEJMra051884. PMID: 16371634.
- Dissertationsschrift von Oliver Dangel „Wirkung von Stickstoffmonoxid auf die Thrombozytenfunktion von Guanylyl-Cyclase- defizienten Mäusen.“ 2007
- Bauer M. (1996) Stickstoffmonoxid. In: Bardenheuer H.J., Hilfiker O., Larsen R., Radke J. (eds) Der Anaesthesist Weiterbildung für Anästhesisten 1997. Springer, Berlin, Heidelberg. https://doi.org/10.1007/978-3-642-60882-7_11
- Lei C, Berra L, Rezoagli E, Yu B, Dong H, Yu S, Hou L, Chen M, Chen W, Wang H, Zheng Q, Shen J, Jin Z, Chen T, Zhao R, Christie E, Sabbisetti VS, Nordio F, Bonventre JV, Xiong L, Zapol WM. Nitric Oxide Decreases Acute Kidney Injury and Stage 3 Chronic Kidney Disease after Cardiac Surgery. Am J Respir Crit Care Med. 2018 Nov 15;198(10):1279-1287. doi: 10.1164/rccm.201710-2150OC. PMID: 29932345; PMCID: PMC6290943.
- Valdivielso JM, Blantz RC. Acute renal failure: is nitric oxide the bad guy? Antioxid Redox Signal. 2002 Dec;4(6):925-34. doi: 10.1089/152308602762197461. PMID: 12573141.
- Brunini TM, Moss MB, Siqueira MA, Santos SF, Lugon JR, Mendes-Ribeiro AC. Nitric oxide, malnutrition and chronic renal failure. Cardiovasc Hematol Agents Med Chem. 2007 Apr;5(2):155-61. doi: 10.2174/187152507780363214. PMID: 17430138.
- Adhikari NK, Burns KE, Friedrich JO, Granton JT, Cook DJ, Meade MO. Effect of nitric oxide on oxygenation and mortality in acute lung injury: systematic review and meta-analysis. BMJ. 2007 Apr 14;334(7597):779. doi: 10.1136/bmj.39139.716794.55. Epub 2007 Mar 23. PMID: 17383982; PMCID: PMC1852043.
- Afshari A, Brok J, Møller AM, Wetterslev J. Inhaled nitric oxide for acute respiratory distress syndrome and acute lung injury in adults and children: a systematic review with meta-analysis and trial sequential analysis. Anesth Analg. 2011 Jun;112(6):1411-21. doi: 10.1213/ANE.0b013e31820bd185. Epub 2011 Mar 3. PMID: 21372277.
- Gebistorf F, Karam O, Wetterslev J, Afshari A. Inhaled nitric oxide for acute respiratory distress syndrome (ARDS) in children and adults. Cochrane Database Syst Rev. 2016 Jun 27;2016(6):CD002787. doi: 10.1002/14651858.CD002787.pub3. PMID: 27347773; PMCID: PMC6464789.


Vielen Dank für den schönen Artikel! Da es in unserer Klinik keine iNO-Therapie für Erwachsene gibt, bin ich auf diesem Gebiet bisher völlig blank gewesen.
Kleine Anmerkung zur intrazellulären Wirkung:
Die Guanylatzyklase führt zur Bildung von cGMP aus GTP. Das geht gut aus der Abbildung hervor, steht aber anders im Text.
Hallo Enno,
vielen Dank für deine Rückmeldung! Ich habe den Text entsprechend deiner Anmerkung angepasst und freue mich sehr über solch aufmerksame Leser!
Ganz herzliche Grüße und danke nochmal, Dana von den Pin-up-docs =)
Pingback: "titriert" NO-Beatmung - pin-up-docs - don't panic