Die Blutgasanalyse

Die Blutgasanalyse ist ein Point-of-care-Verfahren und stellt eine Zusammenschau von Laborparametern zur Überwachung der respiratorischen Funktion, des Säure-Basen-Haushaltes und der Elektrolyte zur Verfügung. Sie bildet damit einen wesentlichen wenn nicht sogar unumgänglichen Teil der modernen Diagnostik in der Anästhesiologie, Intensiv- und (innerklinischen) Notfallmedizin. Im Folgenden wollen wir euch einen Überblick über die relevanten Parameter, pathologischen Veränderungen und therapeutischen Optionen geben.
Grundlagen
Leider kommen wir bei der Interpretation einer Blutgasanalyse nicht darum herum, uns mit den physiologischen Grundlagen zu beschäftigen.
pH-Wert
Der pH-Wert (Abkürzung für lat. pondus hydrogenii [Potential des Wasserstoffs]) ist ein Maß für den sauren oder basischen Charakter einer wässrigen Lösung (in unserem Fall meist des verwendeten Blut-Plasmas). Er gibt die Konzentration (bzw. die Aktivität) der Wasserstoffionen als negativ dekadischen Logarithmus an und ist eine Größe der Dimension Zahl (früher dimensionslose Zahl). Je höher die Konzentration der Wasserstoffionen in der Lösung ist, desto niedriger ist auch der pH-Wert. Eine Veränderung des pH-Wertes um 1 bedeutet eine Veränderung der Wasserstoffionenkonzentration um das 10-fache!
Der pH-Wert des Blutes hängt hauptsächlich von dem Verhältnis zwischen Bicarbonat und CO2 ab. Dieses Verhältnis liegt physiologischerweise etwa bei 20:1. Solange dieses Verhältnis unabhängig von der absoluten Größe konstant ist, ist auch der pH-Wert konstant.
Der physiologische pH-Wert des arteriellen Blutes liegt zwischen 7,36 und 7,44. Alle Werte unterhalb von 7,36 werden als Azidose bezeichnet – alle Werte oberhalb von 7,44 als Alkalose.
Regulationsmechanismen
Durch externe Zufuhr und verschiedene Stoffwechselvorgänge fallen ständig Säuren an. Um dennoch das physiologische Milieu aufrechtzuerhalten hat unser Körper einige Regulationsmechanismen:
- Kohlensäure-Bicarbonat-Puffersystem
- Ventilation
- renale Regulation
Neben dem Kohlensäure-Bicarbonat-Puffersystem sind noch Plasmaproteine und Hämoglobin als Puffersysteme von Bedeutung.
Kohlensäure-Bicarbonat-Puffersystem
Der Kohlensäure-Bicarbonat-Puffersystem ist (mit ca. 70% der Gesamtpufferkapazität) das wichtigste Puffersystem in unserem Körper.
Im Stoffwechsel anfallendes CO2 diffundiert in die Erythrozyten und wird dort zusammen mit Wasser (H2O) in Bicarbonat (HCO3–) und H+ umgewandelt. 85% des anfallenden CO2 werden in dieser Form transportiert. In der Lunge findet dann die entgegengesetzte Reaktion statt und das CO2 wird über einen Partialdruckausgleich an die Ausatemluft abgegeben.
Ventilation
Durch eine Steigerung und Senkung des Atemminutenvolumens (AMV) und somit der alveolären Ventilation kann unser Körper (und natürlich auch der Körper unserer Patient*innen) kurzfristig pH-Verschiebungen kompensieren.
Bei einer metabolischen Azidose (pH-Wert <7,36 und somit vermehrt saure Valenzen) kann das AMV um das 10-fache gesteigert werden. Das pCO2 fällt jedoch nie unter 10-15 mmHg.
Eine metabolische Alkalose kann durch Hypoventilation kompensiert werden (mehr CO2 und somit mehr Säure). Dieser Mechanismus ist allerdings durch die mit einer Hypoventilation verbundene Hypoxämie limitiert.
Renale Regulation
Bei der renalen Regulation geht es hauptsächlich um die Resorption des vorher filtrierten Bicarbonats. Zusätzlich werden in der Leber toxische Ammoniumionen mit Bicarbonat zur Harnstoffsynthese verwendet und ebenfalls renal eliminiert.
Ziel der Kompensationsmechanismen ist es immer, den Quotienten zwischen Bicarbonat und Kohlensäure nahe 20 – und somit den pH nahe 7,40 zu halten.
Pathophysiologische Veränderungen
Respiratorische Störungen
Eine respiratorische Azidose entsteht bei einem Missverhältniss zwischen CO2-Abgabe und -Produktion. Gründe für eine respiratorische Azidose sind zum Beispiel:
- alveoläre Hypoventilation
- Obstruktion der Atemwege
- Thoraxtrauma
- Schonatmung
- Pneumothorax
- Pleuraerguss
- neuromuskuläre Erkrankungen
- Medikamente
- Muskelrelaxantien
- Gasaustauschstörung
- Pneumonie
- strukturelle Lungenerkrankung
- zentrale Hypoventilation
- Störung des Atemzentrums
- Schädel-Hirn-Trauma
- Tumor
- Meningitis
- Intoxikationen
- Medikamente
- Opiate
- Hypnotika
- Sedativa
- Störung des Atemzentrums
- vermehrte CO2-Produktion
- Maligne Hyperthermie
- Fieber
- Einsatz von Natrium-Bicarbonat als Puffer
- vermehrte CO2-Absorption
- Kapnoperitoneum
- Rückatmung
- Totraum
- verbrauchter Atemkalk
Eine respiratorische Alkalose tritt wesentlich seltener auf als eine Azidose. Der Grund ist eine vermehrte CO2-Abgabe. Gründe für eine respiratorische Alkalose sind zum Beispiel:
- fehlerhafte Beatmung (zu hohes Atem-Minuten-Volumen [AMV])
- Hyperventilation
- psychogen
- hypoxiebedingt
- Aufenthalt in großer Höhe
- strukturelle Lungenerkrankung
- zentrale Atemstörung
Bei länger bestehenden respiratorischen pH-Verschiebungen setzen metabolische Kompensationsprozesse ein.
Metabolische Störungen
Bei einer metabolischen Azidose ist sowohl das Bicarbonat als auch der pH-Wert erniedrigt. Metabolische Azidosen werden entweder durch einen vermehrten Anfall bzw. eine verminderte Ausscheidung von H+-Ionen oder einen vermehrten Verlust an Bicarbonat verursacht. Die Gründe sind vielfältig:
- Lactatazidose
- hypoxiebedingt (anaerober Stoffwechsel der Zellen)
- respiratorische Insuffizienz
- zirkulatorische Insuffizienz
- Schock
- Herz-Kreislaufstillstand
- Herzinsuffizienz
- mitochondriale Störungen (Störungen der Atmungskette)
- nicht hypoxiebedingt
- lactatproduzierende Tumoren
- hypoxiebedingt (anaerober Stoffwechsel der Zellen)
- Ketoazidosen
- alkoholisch
- diabetisch
- Fasten / Hunger
- verminderte renale Ausscheidung von Wasserstoffionen
- akute Nierenschädigung / chronische Nierenerkrankung
- vermehrter Anfall von Wasserstoffionen
- Methanolvergiftung
- Salicylatvergiftung
- renaler Bicarbonatverlust
- akute Nierenschädigung / chronische Nierenerkrankung
- Hypoaldosteronnismus
- Morbus Addison
- Carboanhydrase-Hemmstoffe
- gastrointestinaler Bicarbonatverlust
- Diarrhö
- Ureterosigmoidostomien
Im Gegensatz zu einer metabolischen Azidose treten metabolischen Alkalosen durch einen Verlust an H+-Ionen (Subtraktionsalkalose) oder eine Bicarbonaterhöhung (Additionsalkalose) auf. Die Folge ist ein erhöhter pH-Wert. Gründe:
- Subtraktionsalkalose
- Diuretika
- Hypalbuminämie
- chronisches Erbrechen / Verlust von saurem Magensaft
- Reflux
- Bulimie
- Magenspülung
- Additionsalkalose
- Hyperaldosteronismus (Bicarbonatretention)
- Substitution von Natriumbicarbonat
- Zufuhr von metabolisierbaren Anionen (Lactat, Acetat, Citrat)
Messtechnik
Wie es sich für einen richtigen deep dive in ein Thema gehört, ersparen wir euch auch die Messtechnik nicht. Zum einen weil sie viele Messfehler oder Limitationen erklärt, zum anderen weil es einfach schönes Klugscheißer*innenwissen ist. Erwähnt muss werden, dass herstellende Unternehmen jeweils eine etwas andere Technik verwenden. Wir beziehen uns im folgenden Abschnitt auf eine „häufig“ verwendete bzw. uns geläufige Technik (ABL800 FLEX). Im Zweifel schaut also nochmal in die Anleitung eurer Geräte.
pH
Die Messung des pH-Wertes erfolgt mittels einer Glas-Elektrode. Um eine lange Geschichte abzukürzen sollten wir Folgendes verstehen:
- Der pH-Wert ist proportional zur Aktivität der H+-Ionen.
- Unterschiedliche H+-Ionen-Aktivität in zwei Lösungen erzeugt ein elektrisches Potential zwischen diesen Lösungen.
- Vergleicht man das Potential einer Referenz-Lösung (mit bekanntem pH) mit dem Potential der Blutprobe, kann man den pH errechnen.
Es wird immer das Potential zwischen einer genormten Pufferlösung und der Probe gemessen. Einerseits Pufferlösung gegen die Referenzlösung und anderseits Pufferlösung gegen die Blutprobe.
Diese Technik ist – basierend auf den verwendeten Lösungen – nur in gewissen Grenzen genau. Bei unseren Geräten für pH-Werte zwischen 6,3 und 8,0.

Temperaturabhängigkeit der pH-Messung
Genau genommen messen wir also nicht die H+-Ionen-Konzentration sondern deren Aktivität. Die Aktivität von H+-Ionen ist aber abhängig von der Temperatur. (Klugscheißer*innen unter euch könnten jetzt anführen, dass es so etwas wie freie H+-Ionen gar nicht gibt, aber das führt zu weit…). Fakt ist: „Höhere Temperaturen führen zu mehr H+-Ionen-Aktivität“.
Wir versuchen das ganze mal zu verdeutlichen. Destilliertes Wasser hat je nach Temperatur folgende pH-Werte:
- -35°C = pH 8,5
- 0°C = pH 7,5
- 25°C = pH 7,0
- 37°C = pH 6,8
- 300°C = pH 6,0
Mir fällt es tatsächlich schwer, mir 300°C heißes Wasser in flüssiger Form vorzustellen, wobei mir natürlich klar ist, dass es sich nur um eine Frage des Drucks handelt. Ein weiterer bemerkenswerter Punkt ist, dass Wasser bei 37°C (also Körpertemperatur) einen pH von 6,8 aufweist, unser Blut hingegen bei gleicher Temperatur basisch ist.
Jetzt könnten wir noch über pH-Unterschiede zwischen intrazellulärer und extrazellulärer Flüssigkeit reden, aber ich rate euch: „Navigiert vorsichtig an den Rändern dieses tiefen Hasenbaus!!1!“

Alpha-stat- und pH-stat-Modell
Im Alpha-stat-Modell korrigieren wir den pH-Wert immer auf 37°C, unabhängig von der wahren Körpertemperatur. Im pH-stat-Modell hingegen korrigieren wir die entnommene Blutprobe zur „wahren“ Körperkerntemperatur.
Es gibt allerdings einige – aus unserer Sicht gute – Gründe für das Alpha-stat-Modell: Wenn wir das pH-stat-Modell verwenden, bekommen wir Werte, die wir nicht interpretieren können. Wenn wir die Normwerte, die wir kennen (und die für 37°C gelten), auf eine andere Temperatur anwenden, missinterpretierten wir die Zahlen, die uns das Gerät ausspuckt. Dies wird noch verschlimmert, weil andere Systeme unseres Körpers bei anderen Temperaturen auch anders arbeiten (z.B. Protein-Puffer, Hämoglobin) und auch die Löslichkeit der Atemgase temperaturabhängig ist.
pCO2
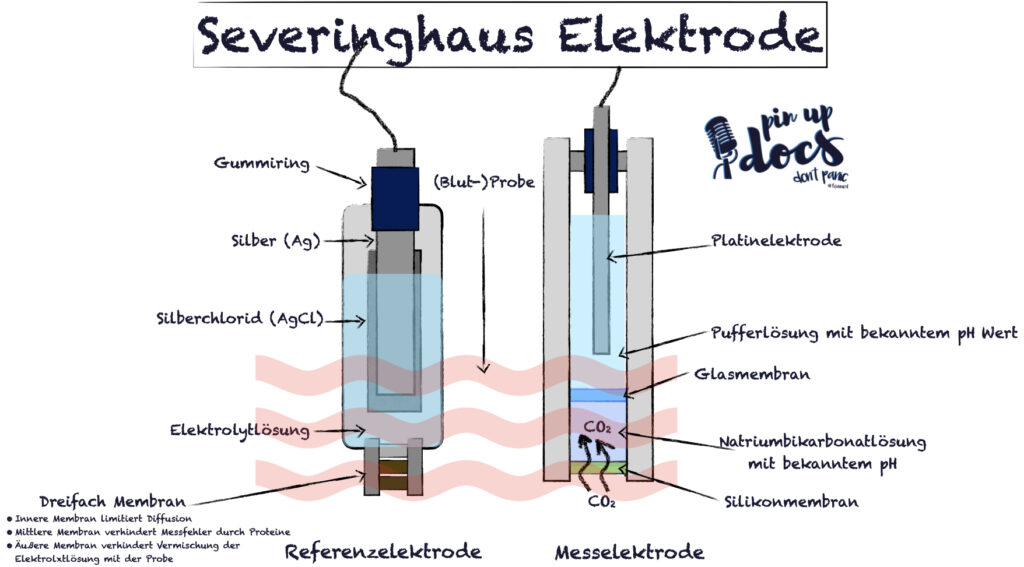
Die CO2-Messung erfolgt über die sogenannte Severinghaus-Elektrode. Diese funktioniert nach dem gleichen Prinzip wie eine Glas-Elektrode, nur dass eine NaBic-Lösung mit einer semipermeablen (für CO2 durchlässige) Membran dazwischen geschaltet ist. Das CO2 aus der Blutprobe diffundiert in das NaBic und ändert dort den pH-Wert. Diese pH-Wert-Änderung wird wiederum von einer Glas-Elektrode gemessen. Da die pH-Wert-Änderung im NaBic nur vom CO2 abhängig ist, kann der CO2-Wert aus dem pH-Wert errechnet werden.
pO2
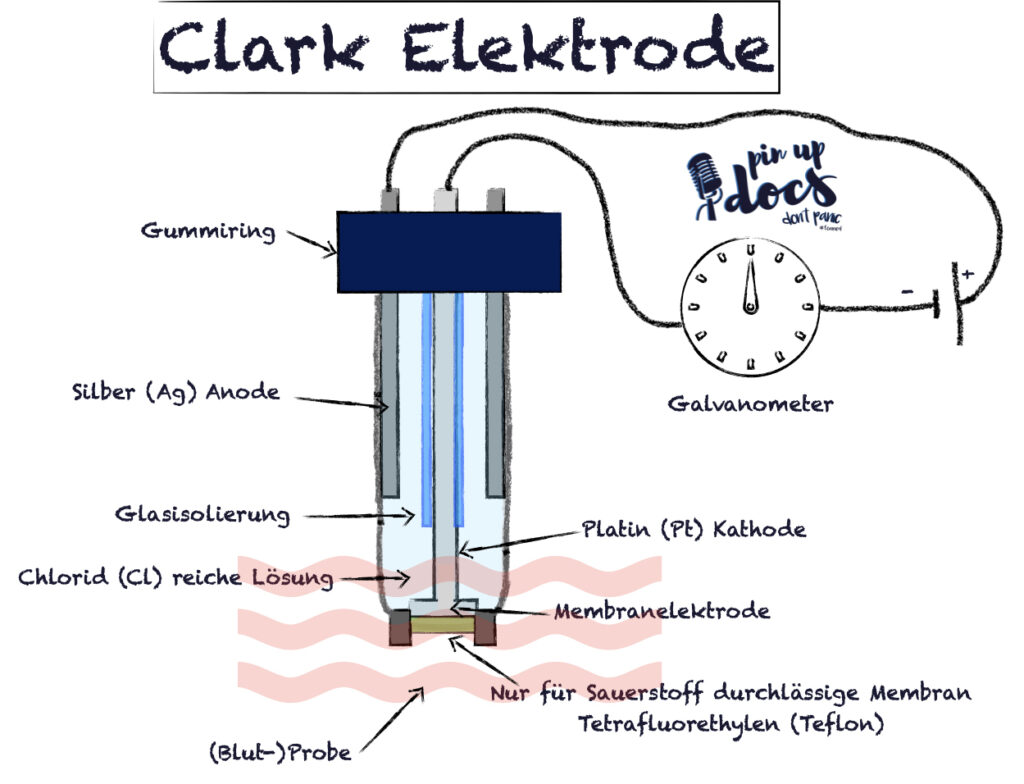
Die Clark-Elektrode besteht meist aus einer Platin-Kathode und einer Silber-Anode, die über eine Elektrolytlösung in Verbindung stehen. Vom Messgut sind diese Metallelektroden in der Regel durch eine sauerstoffdurchlässige (Teflon-)Membran getrennt. Gibt man die Messelektrode in eine Blutprobe, so diffundiert O2 entsprechend seinem Partialdruck durch die Membran in die Messkammer und wird dort an der Kathode reduziert. Es ergibt sich folglich ein Strom, der abhängig von der Sauerstoff-Konzentration in der Blutprobe ist.
cHCO3–
Im BGA-Gerät wird Bicarbonat auf Grundlage des gemessenen pH und pCO2 berechnet (deswegen steht das kleine „c“ davor). Im Gegensatz dazu wird es im Labor über direkt enzymatische Assays gemessen. Die Berechnung ist allerdings sehr genau, besonders wenn man bedenkt, dass sich der Bicarbonat-Gehalt einer Probe mit der Zeit zwischen Abnahme und Analyse ändert (Es ist ja hoffentlich schneller im BGA-Gerät).
Standard-Bicarbonat
Der Standard-Bicarbonat wird gemessen NACHDEM das Blut auf „Normal-Werte“ gesetzt wurde:
- pCO2 = 40 mmHg
- pO2 = > 100 mmHg
- Temperatur = 37°C
Was sagt uns dieser Wert also? Er gibt an, wie der Bicarbonat-Wert sein SOLLTE, wenn alle NICHT-metabolischen Einflüsse ausgeschaltet werden. „Wie wäre der Bicarbonat-Wert, wenn ich vernünftig beatmen und wärmen würde?“
Base Excess
Die Messung erfolgt anhand der Überlegung, welche Menge einer Säure / Base in mmol notwendig wäre, um 1 Liter Blut mit einer Temperatur von 37°C und einem paCO2 von 40 mmHg wieder auf einen pH-Wert von 7,4 auszugleichen. Die Berechnung erfolgt dann anhand von Algorithmen. „Wie wäre der Bicarbonat Wert, wenn ich meine Patient*in vernünftig beatmen und wärmen würden?“
Warum spucken uns die Maschinen gleich einen für Temperatur und Beatmung korrigierten Wert aus? Weil kein Mensch mit einem einigermaßen normalen IQ so etwas (Änderungen im metabolischen und respiratorischen System) interpretieren kann… Deswegen kümmern sich selbst unsere BGA-Geräte nicht um sowas.
Standard Base Excess
Die Messung erfolgt anhand der Überlegung welche Menge einer Säure / Base in mmol notwendig wäre, um 1 Liter Blut mit einer Temperatur von 37°C, einem paCO2 von 40 mmHg UND einer Anämie von 5 g/dl wieder auf einen pH-Wert von 7,4 auszugleichen. Warum basteln wir uns künstlich anämische Patient*innen? Um die Pufferfunktion des Hämoglobin zu egalisieren. Der Standard Base Excess kann als der Base Excess der Extrazellulärflüssigkeit verstanden werden. Allerdings weichen diese Werte nur sehr wenig voneinander ab.
Elektrolyte
Genau wie beim pH-Wert messen wir mittels zweier unterschiedlicher Elektroden eine Differenz. Auf der einen Seite eine Referenz-Flüssigkeit und auf der anderen Seite unsere Probe. Alle Bedingungen außer unser Messwert werden mithilfe einer semipermeablen Membran normalisiert.
Wenn die Referenzflüssigkeit und unsere Probe die eine identische Konzentration des zu messenden Elektrolyts aufweisen, sollte die Potentialdifferenz bei 0 mV liegen. In allen anderen Fällen kann anhand der Differenz die Konzentration berechnet werden.
Leider ist dieser theoretische Zusammenhang in der Praxis nicht immer perfekt. Jedes (andere) gleich geladene Ion führt zu Interferenzen, sodass wir immer mit einer gewissen Unschärfe leben müssen. Diese ist allerdings (meist) im klinischen Alltag zu vernachlässigen.
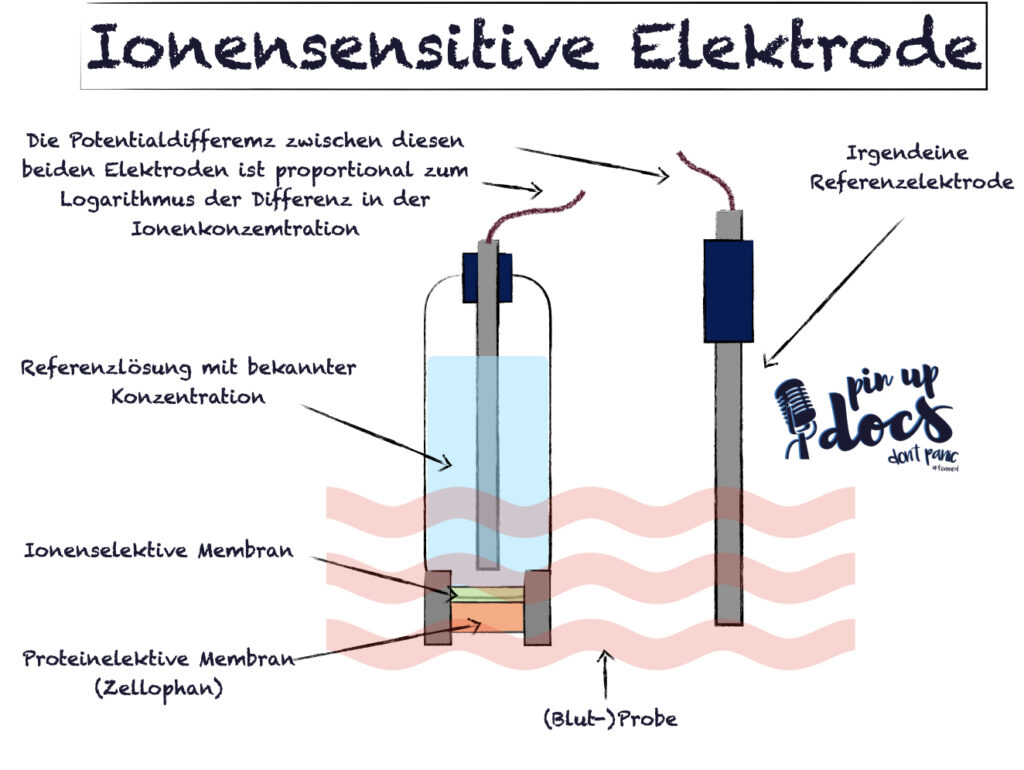
Kalium
Die kaliumdurchlässige Membran ist interessant, da die Innere Schicht aus Valinomycin besteht. Valinomycin ist ein ringförmiges Makrolid-Antibiotikum. Die Poren haben einen Durchmesser von zwischen 2,7 und 3,3 Angström. Ein Kalium-Ion hat einen Durchmesser von 1,33 Angström. Dies macht eine valinomycin-imprägnierte Membran 5000-fach selektiver für Kalium als für Natrium.
Die Messgrenzen der BGA-Geräte liegen zwischen 0,5 und 25 mmol/l. Unserer Erfahrung nach bewegen sich die Werte unserer noch lebenden Patient*innen zu 99,9% in diesem Bereich.
Natrium
Die Natrium-Membran ist vergleichweise unspektakulär. Es handelt sich um einen Keramikstift, dessen Porengröße Natrium-Ionen bevorzugt.
Die Messgrenzen dieser Elektroden liegen zwischen 10 und 250 mmol/l und decken den physiologischen Bereich damit auch „sicher“ ab.
Interferenzen können durch hohe Konzentrationen anderer positiv geladener Ionen, wie Lithium und Kalium entstehen. Die Tatsache, dass Natrium das häufigste extrazelluläre Elektrolyt ist und die hohe Selektivität des Keramikstiftes machen dermaßen hohe Kalium- oder Lithium-Spiegel allerdings klinisch irrelevant.

Wie misst das Labor eigentlich Natrium? Entweder flammenspektroskopisch oder per indirekter ionenselektiver Elektrode. Gerade die indirekte ionenselektive Elektrode hat einige Nachteile, da die Probe verdünnt wird (1/10). Dies führt gerade bei starken Verschiebungen der Protein- und/oder Lipidwerte zu Messfehlern.
- Hyperproteinämie = Hyponatriämie
- Hypoproteinämie = Hypernatriämie
Diese Verschiebungen sind nicht irrelevant, da sie bis zu 20 mmol/l ausmachen können, z.B. bei einer Hypoproteinämie im Rahmen einer Leberinsuffizienz oder einer Hyperproteinämie im Rahmen eines Multiplen Myeloms. In diesen Fällen scheint eine direkte Messung mittels BGA einer laborchemischen Bestimmung überlegen zu sein.
Calcium
Die Messung erfolgt – der Kalium-Messung sehr ähnlich – über eine beschichtete ionenselektive PVC-Membran. Diese Membran lässt nur freies (ionisiertes) Calcium in die Messkammer. Calcium, das an Albumin oder in Chelatkomplexen gebunden ist, muss draußen bleiben und wird nicht vom BGA-Gerät gemessen. Das freie Calcium ist aber auch das Calcium, auf das unser Körper (z.B. bei der Blutgerinnung) zugreifen kann. Somit wird hier der einzig sinnvolle Wert ermittelt.
Der Messbereich dieser Elektrode liegt zwischen 0,2 und 9,99 mmol/l. Damit sollte wiederum jeder lebende menschliche Organismus abgedeckt sein.
Eine Hemmung der Iodaufnahme mittels Perchlorat (Hyperthyreose + Kontrastmittel) führt zu falsch niedrigen Calcium-Messungen in der BGA.
Chlorid
Auch hier erfolgt die Messung über eine beschichtete ionenselektive PVC-Membran. Auch hier befinden wir uns mit einem Messbereich von 7 bis 350 mmol/l sicher im mit dem Leben zu vereinbarenden Bereich.
Glucose
Leider ist Glucose ein elektrochemisch inertes Molekül, sodass für die Messung ein Trick notwendig ist: Der Trick heißt Glucoseperoxidase. Die Glucose-Oxidase ist ein Enzym, das aus Glucose oxydiert, so dass Gluconolacton und Wasserstoffperoxid entsteht (diese Reaktion kann nur in Anwesenheit von Sauerstoff erfolgen und eine Messung wäre unter Sauerstoffausschluss nicht möglich – in der Praxis ist in einer Blutprobe ausreichend Sauerstoff vorhanden). Wasserstoffperoxid wiederum kann einfach reduziert und somit elektrochemisch über eine Elektrode (ähnlich der Clark-Elektrode: Platin-Kathode und Silber-Anode) gemessen werden.
Vereinfacht gesehen besteht eine Glucose-Elektrode aus 3 Bereichen:
- eine externe glucose-permeable Membran
- ein mittlerer Bereich mit Glucose-Oxidase
- eine interne wasserstoffperoxid-permeable Membran
Auch wenn die externe Membran nicht so selektiv ist, bietet die Glucose-Oxidase einen zusätzlichen Filter, da sie sich hauptsächlich für die Glucose interessiert. Nichtsdestotrotz gibt es einige Moleküle, die zu Interferenzen führen können: Lactat, Bilirubin, Harnstoff, Ascorbinsäure, Paracetamol, Alkohol, Salizylate, Citrat, EDTA, Heparin.
Diese Messmethode erlaubt einen Messbereich zwischen 0 und 1000 mg/dl (0 bis 60 mmol/l) und ist somit deutlich besser als die üblichen BZ-Geräte die ja irgendwann nur noch „High“ und „Low“ ausspucken.

Lactat
Im Gegensatz zur Glucose wäre eine direkte Lactat-Messung theoretisch möglich. Allerdings wäre der benötigte Strom so hoch, dass auch andere Moleküle reduziert und somit gemessen werden würden. Daher erfolgt die Lactat-Messung analog zur Glucose-Messung. Die Elektrode besteht erneut aus 3 Bereichen:
- eine externe lactatpermeable Membran
- ein mittlerer Bereich mit Lactat-Oxidase
- eine interne wasserstoffperoxid-permeable Membran
Wer aufmerksam gelesen hat wird feststellen, dass lediglich das Wort Glucose durch Lactat ersetzt wurde. Die Lactat-Oxidase oxidiert Lactat zu Pyruvat und Wasserstoffperoxid. Das Wasserstoffperoxid wird dann genau wie bei der Glucose elektrochemisch gemessen.
Interferenzen entstehen durch die gleichen Moleküle wie bei der Glucose-Messung: Glucose, Bilirubin, Harnstoff, Ascorbinsäure, Paracetamol, Alkohol, Salizylate, Citrat, EDTA, Heparin.
Exkurs Glykolsäure: Ein weiteres Molekül, das zu Fehlmessungen bei der Lactat-Bestimmung führen kann, ist die Glykolsäure. Diese wird ebenfalls von der Lactat-Oxidase als Substrat akzeptiert und führt zu falsch hohen Lactat-Spiegeln. Klinisch relevant wird dies im Rahmen von Ethylenglykol-Vergiftungen. Ethylenglykol ist in Frostschutzmittel enthalten. Wenn es in den Organismus gelangt, wird es von der Alkoholdehydrogenase unter anderem zu Glykolsäure verstoffwechselt.
Der Messbereich liegt mit 0 bis 30 mmol/l ausnahmsweise einmal nicht weit oberhalb des mit dem Leben zu vereinbarenden Bereichs. Aber würde sich unser klinisches Management wirklich ändern, weil der Lactat-Spiegel bei 40 mmol/l anstatt bei 30 mmol/l liegt?

Hämoglobine
Die Messung erfolgt mittels Absorbtionsspektroskopie und zwar mit 128 Wellenlängen im Bereich 478-672 nm (Vergleich: Die herkömmliche SpO2-Messung erfolgt mit 2 Wellenlängen). Die Absorption im Bereich der unterschiedlichen Wellenlängen wird grafisch aufgetragen.
Gesamt-Hämoglobin (ctHb = concentration of total haemoglobin)
Wie der Name schon sagt, handelt es sich um die Messung des GESAMT-Hb. Der Wert sagt somit nur bedingt etwas über die Sauerstofftransportkapazität und gar nichts über die Funktionalität der Hb-Anteile aus.
Aus den Graphen der unterschiedlichen Wellenlängen kann die Gesamtabsorption ermittelt werden. Sie entspricht also der Summe aus oxygeniertem Hämoglobin, desoxygeniertem Hämoglobin, Carboxyhämoglobin und Methämoglobin.
ctHb = cO2Hb + cHHb + cCOHb + cMetHb
Messfehler können entstehen, wenn Substanzen im Blut vorhanden sind, die ähnliche Absorptionseigenschaften ausweisen. Zum Beispiel:
- fetales Hämoglobin
- Sulfhämoglobin
- Intralipid
Wie ihr euch vielleicht denken könnt: Je höher die Konzentration der Interferenzen im Blut, desto höher die Absorption. Je höher die Absorption, desto höher die (falsche) ctHb.

Einige dieser Interferenzen werden vom BGA-Gerät erkannt und korrigiert. Fetales Hämoglobin hat zum Beispiel eine etwas andere Absorptionskurve als adultes, sodass es gemessen und vom Gesamt-Hämoglobin subtrahiert wird. Je nach Ausführung des BGA-Gerätes wird euch auch die HbF-Konzentration angezeigt.
Wenn du regelmäßig BGAs interpretierst, hast du vielleicht schon festgestellt, dass die Hb-Werte in der BGA zum Teil erheblich von den im Labor bestimmten Werten abweichen. Welchem Wert können wir also trauen? Ein schwierige Frage…
Der Goldstandard (= Referenzmethode) ist die Cyanhämoglobin-Methode. Hierbei werden alle im Blut enthaltenen Hb-Derivate (außer Sulfhämoglobin) mittels Reagenz in Cyanhämoglobin umgewandelt. Dieses ist sehr stabil und kann photometrisch gemessen werden. An dieser Methode müssen sich alle anderen Methoden messen.
Für den klinischen Alltag ist es aus unserer Sicht wichtig, sich auf eine Methode einzustellen und gerade Verlaufskontrollen mit der gleichen Methode durchzuführen, da es sonst schnell zu Missinterpretationen kommen kann.
Oxyhämoglobin (FO2Hb; sO2)
Es gibt zwei Möglichkeiten, den Anteil an sauerstoffgesättigtem Hämoglobin anzugeben.
Zum einen gibt es die fraktionelle Sättigung (FO2Hb), die den Anteil von Oxyhämoglobin am Gesamt-Hb beschreibt.
Zum anderen gibt es die funktionelle Sättigung (sO2), die den Anteil von Oxyhämoglobin am Hämoglobin beschreibt, das tatsächlich am Sauerstofftransport beteiligt ist.
Wenn du einen Moment darüber nachdenkt, merkst du, dass dies nicht das Gleiche ist. Beim Gesunden werden sich diese Werte kaum unterscheiden (auch wenn die sO2 immer etwas höher ist, da jeder einen gewissen – wenn auch sehr kleinen – Anteil an FMetHb und FCOHb hat). Im Falle einer CO-Vergiftung oder einer Methämoglobinämie sieht das Ganze schon anders aus.
Welchen Wert nutzen wir also? Es kommt drauf an…
sO2 kann euch im Falle einer CO-Vergiftung in Schwierigkeiten bringen, wenn die sO2 zwar 99% ist, aber nur 10% des ctHb für den O2-Transport zur Verfügung stehen.
Andererseits wissen wir, dass wir bei einer sO2 von nur 80% noch Möglichkeiten haben unseren Patient*innen mit einer gesteigerten O2-Zufuhr zu helfen. Dies ist bei einer FO2Hb von nur 80% nicht zwangsläufig der Fall.
Methämoglobin (FMetHb)
Methämoglobin mit diesen nutzlosen (nicht zum Sauerstofftransport geeigneten) Eisen3+-Atomen hat ein anderes Absorptionsspektrum als das häufig vorkommende oxygenierte Hämoglobin und kann somit leicht gemessen werden. Zu Interferenzen kann hier Methylen-Blau führen.
Carboxyhämoglobin (FCOHb)
Auch Carboxyhämoglobin unterscheidet sich im Absorptionsspekturm und kann auf diese Weise gemessen werden. Das Problem mit Carboxyhämoglobin ist, dass es völlig unwillig ist, O2 abzugeben. COHb führt neben der Besetzung von Hämoglobin, welches dann nicht mehr für den O2-Transport zur Verfügung steht, zu einer erhöhten Affinität (Linksverschiebung der Sauerstoffbindungskurve) der nicht betroffenen Hämoglobine. Dies führt zu einer gestörten Sauerstoffabgabe im Gewebe.
Bei einem Nichtraucher liegt der normale COHb-Spiegel bei 1%.
Hämatokrit (Hctc)
Der Hämatokrit ist der Anteil zelluläre Blutbestandteile am Volumen des Blutes. Da die roten Blutkörperchen physiologisch 99% des Gesamtvolumens der Blutzellen darstellen, entspricht ihr Anteil am Blutvolumen ungefähr dem Hämatokrit. Wir können also davon ausgehen, dass der Hctc direkt proportional zum ctHb ist. Unser BGA-Gerät berechnet den Hämatokrit wie folgt:
Hctc = 0.0485 × ctHb + 8.3×10-3
Diese Beziehung ist so lange relativ genau wie folgende Rahmenbedingungen eingehalten werden:
- Die ctHb Messung ist korrekt
- Die Erythrozyten erhalten die erwartete Menge Hämoglobin (normales MCHC)
- Die Probe enthält kein freies Hämoglobin (Hämolyse)
Proben
Eine Blutgasanalyse (BGA) ist prinzipiell sowohl aus venösem, als auch aus arteriellem Blut möglich.
Arterielle Blutproben
Um die respiratorische Funktion überprüfen zu können, ist vor allem eine Untersuchung des arteriellen Blutes notwendig. Hierbei wird der Partialdruck der Atemgase (O2-Partialdruck und CO2-Partialdruck), die Sauerstoffsättigung, der pH-Wert, das Standardbikarbonat und ein möglicher Basenüberschuss bestimmt.
Die arterielle Probenentnahme ist durch Punktion einer Arterie oder aus einem arteriellen Katheter möglich.
Anhand der Zusammenschau der Befunde ist es dann möglich bei etwaigen pH-Verschiebungen auch Ursachen für die vorliegende Azidose/Alkalose zu differenzieren.
Venöse Blutproben
Zentralvenöse Blutproben:
Abnahme über einen Zentralenvenenkatheter. Hierbei wird normalerweise nur das Blut aus der oberen Körperhälfte repräsentiert, nicht das Blut des gesamten Körpers.
Neben der Analyse der pO2– und pCO2-Werte kann auch die Beurteilung der zentralvenösen Sättigung sinnvoll sein und einen Rückschluss auf das Herz-Zeit-Volumen zulassen.
Gemischt-venöse Blutproben:
Eine gemischt-venöse BGA ist nur aus dem Blut der A. pulmonalis möglich. Hier wird das Blut der oberen und unteren Körperhälfte, sowie das Blut aus dem Sinus coronarius vermischt. Bei der Abnahme ist zu beachten, dass über den Pulmonaliskatheter abgenommen wird, dieser sich aber nicht in der sogenannten „Wedge-Position“ befinden darf und das Blut langsam (<2 ml/ 10 Sek) abgenommen werden sollte um kein oxygeniertes Blut aus den Kapillaren zu aspirieren.
Neben der Analyse der pO2– und pCO2-Werte kann auch die Beurteilung der gemischt-venösen Sättigung sinnvoll sein. Diese kann noch genauere Rückschlusse auf das Herz-Zeit-Volumen zulassen als die zentralvenöse Sättigung, da hier der gesamte Körper betrachtet werden kann.
Bei einer erniedrigten zentral- oder gemisch-venösen Sättigung muss eine hohe Sauerstoffausschöpfung in der Peripherie in Betracht gezogen werden, die oft durch eine Herzinsuffizenz bedingt ist. Erhöhte Werte sind zum Beispiel im Rahmen einer Sepsis zu finden. Die gemischt-venöse und die zentralvenöse Sauerstoffsättigung beträgt üblicherweise 70 – 75 %, was einem Sauerstoffpartialdruck von ca. 40 mmHg entspricht. Die zentralvenöse Sättigung ist um ca. 5% niedriger als die gemischt-venöse Sauerstoffsättigung.
Peripher-venöse Blutproben:
Peripher-venöse Blutproben eignen sich nicht gut für eine pO2– oder pCO2-Analyse, da die Partialdrücke zu stark abhängig von der vorherrschenden lokalen Perfusion sind. Eine Analyse des Säure-Basen-Haushaltes und der Elektrolyte ist aber möglich.
Kapillarblut:
Bei Neugeborenen und Kleinkindern kann man arterialisiertes Kapillarblut für eine BGA verwenden (entnommen z.B. aus dem Ohrläppchen oder der lateralen Ferse). Finger der rechten Hand sind bevorzugt zu verwenden, wenn bei einem noch offenen Ductus arteriosus botalli das präduktale Blut analysiert werden soll.
Aufbewahrung und Abnahme der Probe:
Eine abgenommene Probe sollte gekühlt werden, wenn eine sofortige Analyse nicht möglich ist.
Auch bei der Abnahme der BGA gibt es etwas zu beachten:
BGA-Spritzen können einen herausfordern, denn trotz sorgfältigster Abnahme kennen wir es doch alle, dass sich eine kleine Luftblase bildet, die bei dem Versuch diese zu entfernen im ungünstigeren Fall sich auch noch zu mehreren kleinen Luftblasen entwickelt. Warum ist das ein Problem?
Zwischen Blut und Luftblasen kommt es (mit zunehmender Oberfläche der Luftblasen) durch ein möglicherweise vorhandenes Konzentrationsgefälle zu einer Diffusion von CO2 und O2. Kohlendioxid diffundiert in die Luftblase und auch O2 kann diffundieren – je nach vorliegendem Sauerstoffpartialdruck im Blut. Hierbei kann es zu einer Diffusion von der Luftblase in das Blut kommen, wenn der Partialdruck im Blut niedriger als 160 mmHg ist (eine Luftblase aus Raumluft hat ungefähr einen Partialdruck von 160 mmHg). Sollte der Sauerstoffpartialdruck des Blutes höher sein als 160 mmHg, kann O2 aber auch in die Luftblase diffundieren.
Deshalb gilt: Wenn eine Luftblase mehr als 2 Minuten in der Probe bleibt, muss mit Diffusionsreaktionen gerechnet werden.
Ein weiterer wichtiger Hinweis: Es sollten spezielle BGA-Spritzen verwendet werden, die mit Heparin als Antikoagulans benetzt sind. Deshalb wird auch diskutiert und oft propagiert, dass die Abnahme einer Gerinnung immer vor der BGA stattfinden soll. Bei Vollheparinisierung (z.B. während einer koronaren Bypass-OP unter Verwendung einer Herz-Lungen-Maschine) ist die Verwendung von heparinisierten Spritzen nicht notwendig.
Parameter:
paO2
Wird in der Regel in mmHg angegeben (selten auch in kPa; Umrechnung Partialdruck in kPa x 7,5 = Partialdruck in mmHg). Die Normalwerte für paO2 sind altersabhängig. Als Anhalt für einen physiologischen paO2 kann gelten: paO2 = 100,1 – (0,323 x Alter in Jahren).
Der pO2 kann verändert sein, wobei ein Abweichen unterhalb des Normbereichs als Hypoxie und ein Abweichen überhalb des Normbereichs als Hyperoxie bezeichnet wird. Eine Hypoxämie bezeichnet einen erniedrigten Sauerstoffgehalt, eine Hyperoxämie einen erhöhten Sauerstoffgehalt im Blut. Hypoxygenation beschreibt eine erniedrigte Sauerstoffsättigung im Blut.
paCO2
Der Kohlenstoffdioxid-Normwert beträgt sowohl endexspiratorisch, als auch im arteriellen Blut 40 ± 5 mmHg. Weicht dieser Wert vom Normbereich ab, spricht man von Hypo- oder Hyperkapnie. Im Bereich der Alveolen wird O2 und CO2 ausgetauscht. Im Normalfall ist der paCO2 im Blut nur minimal höher als der pCO2-Wert in den Alveolen. Nimmt der Unterschied zwischen pCO2 in den Alveolen im Vergleich zum paCO2 zu, liegt ein Mismatch zwischen Ventilation und Perfusion vor. Finden wir eine solche Kombination in unseren Messwerten muss an eine Lungenarterienembolie gedacht werden. Andere Differentialdiagnosen wären Atelektasen, Totraumventialtion oder in gravierenderen Fällen der schwere Schock oder Herz-Kreislauf-Stillstand.
Base Excess (BE)
Der Base Excess ist ein Parameter, der einem Hinweise auf eine metabolische Störung geben kann. Hiermit wird ein Basenüberschuss (positiver BE) bzw. ein Basenmangel (negativer BE) im Gesamten erfasst. Der Normwert für den ABE (aktuellen Base Excess) beträgt 0 ± 3. Eine Temperaturabhängigkeit besteht nicht.
HCO3– / Bicarbonat
Bei diesem Wert handelt es sich um eines von mehreren Puffersystemen des Körpers. Der Normwert beträgt 22 bis 26 mmol/l.
Sauerstoffsättigung
Der Normwert für die arterielle Sauerstoffsättigung beträgt 96 bis 98%, für die zentralvenöse oder gemischt-venöse Sauerstoffsättigung 70-75%. Die Sauerstoffsättigung beschreibt den prozentualen Wert des Gesamthämoglobins, der mit Sauerstoff beladen ist. Das Gesamthämoglobin setzt sich aus desoxygeniertem und oxygeniertem Hämoglobin, sowie COHb und MetHb (s.u.) zusammen. Betrachtet man diese Sauerstoffsättigung des Gesamthämoglobins wird oft von der fraktionellen Sättigung in % gesprochen.
Sauerstoffbindungskurve:
Die Sauerstoffbindungskurve beschreibt grafisch das Verhältnis von Sauerstoffpartialdruck (pO2) zu Sauerstoffsättigung des Hämoglobins (sO2) und hat im Normalfall einen sigmoidalen Verlauf. Dieser Verlauf kommt durch den kooperativen Effekt zustande, der sich aus einer Konformitätsänderung des Hämoglobins ergibt, sobald ein Sauerstoffmolekül an ihm gebunden ist. Der sogenannte „Tense“-Zustand geht in den „Relax“-Zustand über und weitere Sauerstoffmoleküle können nun deutlich einfacher an selbigem Hämoglobin binden, bis alle vier Bindungsstellen gefüllt sind.
Die normale Sauerstoffbindungskurve wird bei optimalen Werten (pH 7,4 und Temperatur 37°C) bestimmt. Eine Linksverschiebung der Kurve bedeutet, dass eine erhöhte Affinität zu O2 besteht, eine Rechtsverschiebung der Kurve, dass die O2-Abgabe im Gewebe verbessert wird.
Sauerstoffstatus
p50
Der p50-Wert beschreibt nun den Sauerstoffpartialdruck (pO2) im Verlauf der sigmoidalen Sauerstoffbindungskurve, bei dem 50% des Hämoglobins mit Sauerstoff gesättigt ist. Dieser Wert spiegelt also den Grad der Rechts- oder Linksverschiebung der Kurve wider.
Ein Sättigungswert von 50% entspricht bei einer normalen Sauerstoffbindungskurve einem pO2 von 26,7 mmHg.
Bei einer Linksverschiebung der Sauerstoffbindungskurve, ist der p50-Wert erniedrigt (in der Lunge physiologisch). Hierbei ist die Sauerstoffaffinität des Hämoglobins in der Lunge erhöht und erleichtert so die Bindung von Sauerstoff. Liegt allerdings eine Linksverschiebung im Gewebe vor, wird die Sauerstoffabgabe hier durch die erhöhte Affinität erschwert und somit die Oxygenierung des Gewebes negativ beeinflusst.
Ursachen eines erniedrigten p50-Wertes können sein:
- Alkalose
- Hypothermie
- Hypokapnie
- HbF (fetales Hämoglobin)
- Kohlenmonoxidvergiftung
- Methämoglobinämie
- Hämoglobinopathien
- Mangel an 2,3-DPG
Im Gegensatz dazu bedeutet eine Rechtsverschiebung der Kurve (erhöhter p50-Wert – zum Beispiel durch eine Azidose), dass die Sauerstoffabgabe im Gewebe erleichtert wird (hier auch physiologisch vorkommend).
Ursachen eines erhöhten p50-Wertes können sein:
- Sepsis
- Azidose
- Hyperkapnie
- Fieber
- Hämoglobinopathien
Oxymetrie-Ergebnisse
Hb
Das Hämoglobin ist das Hauptprotein in Erythrozyten und ist für den Sauerstofftransport durch den Körper essenziell. Die Normwerte variieren je nach Geschlecht und Alter und Quelle. Für Frauen gilt ein Hb von 12-16 g/dl als normwertig, für Männer 13-18 g/dl.
Dyshämoglobine
Viele BGA-Geräte können inzwischen die unterschiedlichen HB-Fraktionen bestimmen und die fraktionellen Sättigungswerte angeben. Die gemessenen Werte sind sowohl in der arteriellen, als auch in der venösen BGA-Messung vergleichbar.
COHb – Carboxyhämoglobin ist Hämoglobin, welches statt Sauerstoff Kohlenstoffmonoxid gebunden hat. Referenzbereich <3%. Die Affinität von Hb zu CO ist bis 300-fach erhöht. Das typische klinische Bild sind fälschlicherweise gute SpO2-Werte und „kirschrote“ Patient*innen. Anmerkung: Der Normwert bei Raucher*innen kann erhöht sein.
MetHb – Methämoglobin ist ein Hämoglobin, welches eine Veränderung des zentralen Eisenatoms aufweist. Ist MetHb entstanden, so ist das sonst zweiwertige Eisenatom zu dreiwertigem Eisen oxydiert und ist dadurch nicht mehr in der Lage Sauerstoff adäquat zu binden. Referenzbereich 0-2%.
HbF – fetales Hämoglobin, weist im Vergleich zu adultem Hämoglobin eine erhöhte Affinität zu Sauerstoff auf (Linksverschiebung der Sauerstoffbindungskurve). Physiologisch bis zu 6 Monate nach der Geburt, weshalb Neugeborene und Säuglinge bis zum 6. Lebensmonat veränderte p50-Normwerte aufweisen.
Hct/Hkt
Hämatokrit – Der Hämatokritwert beschreibt den Volumenanteil von zellulären Bestandteilen des Blutes im Vergleich zu den flüssigen Anteilen. Erythrozyten machen hierbei mit über 95% den größten Anteil aus. Auch hier variieren je nach Quelle die Angaben zu Normwerten: Für (nicht schwangere) Frauen ist ein Hämatokrit von 37-45%, für Männer ein Hämatokrit von 43-50% als normwertig anzusehen.
O2Hb
Spiegelt die fraktionelle Sättigung des oxygenierten Blutes an und wird zum Teil auch FO2Hb genannt.
O2-Content / O2-Gehalt / Ct-O2
BGA-Geräte geben in vielen Fällen einen O2-Gehalt an, der sich aus dem chemisch gebundenen und dem „freien“ physikalisch gelösten Sauerstoff ergibt und wie folgt berechnet wird:
O2-Gehalt = Hb x 1,34 x SaO2 + paO2 x 0,003
Der chemisch gebundene Sauerstoff ist natürlich abhängig von dem aktuellen Hb, aber auch von der Hüfner-Zahl (Sauerstoffbindungskapazität pro Gramm Hämoglobin in ml, 1,34 bzw. mathematisch errechnet 1,39) und der Sauerstoffsättigung (SaO2 – Norm: circa 96-98%, also 0,96-0,98). Hierbei ergibt sich dann zum Beispiel bei einem Hb von 14 g/dl und einer SaO2 von 0,95 (Hüfner-Zahl hier 1,34) ein O2-Gehalt für den chemisch gebundenen Sauerstoff von 17,82 ml/100ml Blut. CAVE: BGA-Geräte, die nicht über ein sogenanntes CO-Oxymeter verfügen, gehen immer von einem normalen „Standard“-Hb aus.
Den physikalisch gelösten Sauerstoff kann man anhand der Löslichkeitskonstante für O2 (αO2 = 0,00314) und dem paO2 mittels Multiplikation errechnen. Hieraus ergibt sich bei einem normalen paO2 von 98 mmHg ein physikalischer gelöster Sauerstoffanteil von 0,308ml/100ml Blut (98 mmHg x 0,00314).
Insgesamt haben wir also – je nach Variablen – circa 18-20ml O2/100ml Blut, was ca. 20 Vol.-% in der Norm entspricht. Bei Werten <10 Vol.-% muss über eine Erhöhung beeinflussbarer Variablen wie O2-Angebot und insbesondere Erythrozyten nachgedacht werden.
FShunt
Die Shuntfraktion bezeichnet den Teil des Blutes, der die Lunge passiert, ohne am Gasaustausch teilzunehmen und – definiert wird das Verhältnis von geshuntetem Herzminutenvolumen am Gesamtherzminutenvolumen. Ein FShunt von 0,1 bedeutet also, dass 10% des venösen Blutes die Lunge ohne Oxygenierung passieren und sich dann mit vollständig oxygeniertem Blut vermischen. Referenzwert: 4-10% für Erwachsene.
Elektrolyt-Ergebnisse
Generelles: In der extrazellulären Flüssigkeit überwiegen unter den Kationen Natrium und unter den Anionen Chlorid und Bicarbonat. Intrazellulär überwiegen Kalium und Phosphatester. Der osmotische Druck des Plasmas ergibt sich aus der Anzahl der gelösten Teilchen. Möchte man dies quantifizieren, kann man die Osmolalität hinzuziehen; die Konzentration aller gelösten Teilchen pro kg Lösungsmedium. Die Konstanthaltung dieser Verhältnisse nennt sich Isoosmolalität oder auch Isotonie. Kommt es zu Veränderungen der Osmolalität, kann dies zu unterschiedlichen Problemen führen.
Natrium
Referenzwert: 135–145 mmol/l
Hyponatriämie:
Serum-Natrium <135 mmol/l, kann unterteilt werden in:
- Hypovolämische Hyponatriämie – ausgelöst durch:
- Renalen Salzverlust (z.B. durch Diuretika, interstitielle Nephritis, Hypoaldosteronismus, renal-tubuläre Azidose, Ketonurie, osmotische Diurese)
- Extrarenalen Salzverlust (Erbrechen, Diarrhö, Pankreatitis, Peritonitis)
- Zerebrale Erkrankungen (z.B. durch Wasserretention bei erhöhter ADH-Ausschüttung)
- Euvolämische Hyponatriämie – ausgelöst durch:
- SIADH (Syndrom der inadäquaten ADH-Sekretion)
- Physiologische ADH-Stimulation bei vermindertem effektiven arteriellen Blutvolumen
- Psychogene Polydipsie (abnorm viel Flüssigkeit zu sich nehmen), Wasserintoxikation
- Hypervolämische Hyponatriämie – ausgelöst durch:
- Leberzirrhose
- Chronische Herzinsuffizienz
- Nephrotisches Syndrom
Klinik: Oft asymptomatisch, Adynamie, Appetitlosigkeit, Übelkeit, Erbrechen, Kopfschmerzen, Somnolenz; bei schneller Entwicklung: Sturzneigung, Gedächtnisstörungen, Krampfanfälle, Koma, Tod (Gefahr einer Einklemmung des Hirnstamms)
Diagnostik:
- 5 wichtige Fragen:
- Zufuhr von zu viel Flüssigkeit?
- Diuretika-Therapie
- GI-Symptome
- klinische Zeichen einer Herzinsuffizienz, einer Leber- einer Nierenerkrankung?
- Grunderkrankung, die zu einem SIADH führen kann?
Therapie: Kausal, Symptomatisch siehe Pin-up-docs „Hyponatriämie„.
Hypernatriämie:
Serum-Natrium > 145 mmol/l
- Mit Zeichen eines Wassermangels: = hypovolämische Hypernatriämie
- Urin-Osmolalität > 800 mmol/kg -> extrarenaler Wasserverlust / ungenügende Wasserzufuhr
- Urin-Osmolalität < 800 mmol/kg -> renaler Wasserverlust
- Anstieg der Urin-Osmolalität nach ADH-Gabe = zentraler Diabetes insipidus
- Fehlender Anstieg der Urin-Osmolalität nach ADH-Gabe: nephrogener Diabetes insipidus oder osmotische Diurese
- Mit Zeichen einer Hypervolämie: unkontrollierte NaCl-Infusion
Klinik: Symptome der ursächlichen Störung, Muskeleigenreflexe erhöht, Ruhelosigkeit, Faszikulationen, ggf. Krampfanfälle
Therapie: kausal, symptomatisch:
- Hypovolämische Form: Volumensubstitution mit G5 + 1/3 des Flüssigkeitsdefizites als iostonische Elektrolytlösung
- Hypervolämische Form: Zufuhr von hypertonen Lösungen stoppen. Ab >160 mmol/L: G5 + Furosemid, bei Nierenversagen: Hämodialyse
Kalium
Referenzwert: 3,6–5,0 mmol/l (abweichend je nach Literatur)
Vorkommen: 98% intrazellulär
Ausscheidung: 90% renal, 10% enteral.
Hypokaliämie:
Kalium <3,6 mmol/l
Pathophysiologisch kommt es bei einer akut eintretenden Hypokaliämie zu einer Abnahme der neuromuskulären Erregbarkeit und im Extremfall zu Muskellähmungen infolge einer Hyperpolarisationsblockade.
Ätiologie:
- Verlustbedingte Hypokaliämie
- Reduzierte orale Zufuhr
- Intestinale Verluste (Diarrhö, Laxanzien, Mukorrhö)
- Renale Verluste (primär durch Nierenerkrankungen [Nephritiden, Renate tubuläre Azidose, Bartter-Syndrom], sekundär renaler Kaliumverlust durch Diuretika, Hypercortisolismus, Hyperaldosteronismus, Therapie mit Gluco-/Mineralocorticoiden, Therapie mit Amphotericin B) (#Renate für alle Podcast-Hörer*innen 😉
- Verteilungsbedingte Hypokaliämie
- Alkalosen
- Insulinbehandlung
Klinik: Adynamie, Paresen, Obstipation bis zum paralytischen Ileus, Abschwächung bis Fehlen der Reflexe, Hypokaliämische Nephropathie möglich, metabolische Alkalose
(Spezifische) EKG-Veränderungen bei akuten Kaliumveränderungen:
- ST-Senkungen, T-Abflachung
- TU-Verschmelzungswelle
- PQ-Verkürzung
Therapie: kausal, symptomatisch: Kaliumreiche Kost, Kaliumsubstitution
Hyperkaliämie:
Kalium > 5,0 mmol/l
Ätiologie:
- Externe Bilanzstörung:
- Übermäßige Zufuhr
- Verminderte renale Kaliumausscheidung
- Akutes Nierenversagen (Bei Anurie steigt das Kalium täglich um etwa 1 mmol/l an)
- Chronische Nierenerkrankung
- M. Addison
- Iatrogen bedingt
- RAAS-Hemmer: ACE-Hemmer, Sartane, Aldosteronantagonisten, Reninhemmer, NSAR
- Medikamente, die die Kaliumsekretion im distalen Tubulus hemmen: Ciclosporin A, Amilorid, Triamteren (= kaliumsparende Diuretika), Cotrimoxazol, Pentamidin
- Übermäßige Zufuhr durch Perfusor 😉
- Interne Bilanzstörung
- Azidose
- Freisetzung bei Zellschäden, Tumorlyse, Cave: Succinylcholin..
- Pseudohyperkaliämie
- Hämolyse der Blutprobe
- Kaliumfreisetzung in Blutprobe bei exzessiver Thrombo- oder Leukozytose
Klinik: Oft asymptomatisch, evtl neuromuskuläre Symptome, Parästhesien, Muskelzuckungen, Paresen
(Spezifische) EKG-Veränderungen bei akuten Kaliumveränderungen:
- Zeltförmiges T mit schmaler Basis
- P-Abflachung
- PQ-Verlängerung
- Schenkelblockartige Deformierung des Kammerteils
- Terminal Übergang in Sinuswellen
- Kammerflimmern oder Asystolie im Extremfall möglich
Therapie:
- Kausal -> Absetzen kaliumretinierender Medikamente bei eingeschränkter Nierenfunktion!
- Symptomatisch:
- Siehe „Pin-up-docs Flowchart Hyperkaliämie“ (Glucose + Insulin z.B. 50 ml G40 + 10iE Insulin über 30 min, NaBic, Calciumgluconat, Salbutamol hochdosiert per inhalationem)
- Forcierte Diurese
- Hämodialyse
- Kationenaustauscherharze
Calcium
Referenzwert (ionisiert): 1,15–1,35 mmol/l
Hypocalcämie:
Gesamtcalcium im Serum < 2,2 mmol/l, ionisiertes Calcium < 1,1 mmol/l
Ätiologie:
- Bei normalem ionisierten Calcium: Hypoalbuminämie
- Bei erniedrigtem ionisierten Calcium und normalem Magnesiumspiegel:
- Hypoparathyreoidismus / Pseudohypoparathyreoidismus
- Vitamin D-Mangel
- Rhyabdomyolyse
- Renal-tubuläre Azidose
- Chronische Nierenerkrankung
- Bei erniedrigtem ionisierten Calcium und niedrigem Magnesiumspiegel:
- Alkoholismus
- Malabsorptionssyndrom
- Medikamenteninduziert
Klinik: Hypocalcämische Tetanie (Parästhesien, Pfötchenstellung, Stimmritzenkrampf), Chvostek-Zeichen (Beklopfen des N. facialis im Bereich der Wange führt zu Zuckung am Mundwinkel), Trousseau-Zeichen (RR-Manschette am Arm mit art. Mitteldruck für einige Minuten führt zu Pfötchenstellung), EKG: QT-Verlängerung
DD: Hyperventilationssyndrom
Therapie: Kausal, Symptomatisch: bei Tetanie: z.B. 10 ml Calcium 10% langsam i.v. und langfristig orale Substitution
Hypercalcämie:
Gesamtcalcium im Serum > 2,7 mmol/l , ionisiertes Calcium > 1,3 mmol/l
Ätiologie:
- Endokrine Ursachen: Primärer Hyperparathyreoidismus
- Tumorinduzierte Hypercalciämie
- Osteolytisch
- Paraneoplastisch
- Kalzitriol-Synthese in Tumorzellen
- Medikamentös induziert:
- Thiaziddiuretika, Vitamin-D- oder -A-Intoxikation, calciumhaltige Phosphatbinder, calciumhaltige Kationenaustauscher, Lithium, Tamoxifen
- Seltene Ursachen:
- Immobilisation
- Sarkoidose
- Familiäre hypocalcurische Hypercalcämie
- Bei Thrombozytose
- Mutationen im Vit-D-katabolisierenden Enzym
Klinik: Evtl Symptome der Grunderkrankung
Hypercalcämie-Symptome:
- Niere: Polydipsie, Polyurie
- Magen/Darm: Erbrechen, Übelkeit, Obstipation, Pankreatitis
- Herz/Skelettmuskulatur: Rhythmusstörungen, QT-Verkürzung im EKG, Adynamie, Muskelschwäche bis hin zur Pseudoparalyse
- ZNS/Psyche: Psychose, Somnolenz bis Koma
Eine hypercalcämische Krise droht bei einem Serumcalcium von > 3,5 mmol/l.
DD: Hyperventilationssyndrom
Therapie: Kausal,
- Symptomatisch:
- Universelle Maßnahmen: Forcierte Diurese, Calciumzufuhr stoppen (CAVE: Herzglycoside und Thiaziddiuretika!), Bisphosphonate, Calcitonin
- Zusätzlich: Glucocorticoide, Hämodialyse
Chlorid
Referenzwert: 98–106 mmol/l
Änderungen der Chloridkonzentration im Serum gehen meist parallel mit den Änderungen des Natriums im Serum einher. Isolierte Abweichungen findet man bei Störungen im Säure-Basen-Haushalt.
Metabolit-Ergebnisse
Lactat
Normwert: 0,6–1,7 mmol/l
Lactat kann bei dem Vorgang der anaeroben Glykolyse in Muskulatur, Herz, Erythrozyten und Nebennierenmark gebildet werden und entsteht hierbei als Stoffwechselprodukt. Deshalb kann man Lactat auch als Ischämie-Parameter ansehen.
Ist das Lactat erhöht, so kann zum einen der pO2 das Problem sein. Dann wären eine zu niedrige FiO2, ein erhöhter Rechts-Links-Shunt, eine Hyperkapnie, oder ein erniedrigter Umgebungs-Luftdruck (der einen erniedrigten Sauerstoffpartialdruck bedingt) mögliche Ursachen. Des Weiteren kann aber auch der ctO2-Wert erniedrigt sein. Dies kann sich aus einem erniedrigten Hb-Wert, einer erniedrigten Sauerstoffsättigung oder einem erhöhten CO-Hb oder Methämoglobinwert ergeben. Auch die Sauerstoffabgabe kann pathologisch verändert sein, was sich in einer Erniedrigung des p50-Wertes widerspiegelt. (Zur Erinnerung: Ein niedriger p50-Wert bedingt eine schlechtere Abgabe von O2 im Gewebe und dadurch eine Minderversorgung.) Diese Erniedrigung kann durch eine Alkalose, eine Hyperventilation, eine Hypothermie, eine Hypophosphatämie (Erniedrigung von 2,3-DPG = Diphosphoglycerat, einem weiteren Regulator der Sauerstoffbindungsaffinität) oder eine Kohlenmonoxidvergiftung bedingt sein, sowie bei Neugeborenen und hämatologischen Störungen entstehen.
Die Lactat-Clearance als einzelnen Parameter zur Steuerung der Flüssigkeitstherapie zu verwenden, führt in den meisten Fällen zu einer Volumenüberladung und sollte deshalb sehr kritisch hinterfragt werden. Natürlich kann aber eine Erhöhung des Lactats in Zusammenschau mit anderen Befunden dennoch hinweisend auf einen Volumenmangel sein.
Glucose
Hiermit wird der aktuelle Blutzucker (BZ) entweder in mg/dl oder in mmol/l angegeben. Ein Blutzucker von 60-109 mg/dl wird hierbei als normwertig angesehen. Bei einem BZ <60 mg/dl sollte Glucose verabreicht werden.
Bei wachen und nicht vigilanz-geminderten Patient*innen: 20-100 g Glucose p.o.
Bei bewusstlosen Patient*innen und gesichertem Venenzugang (Rücklaufprobe!): 8 – 24g Glucose i.v (Rechnung: 100ml G5 enthalten 5g Glucose, 100 ml G20 entsprechen 20g Glucose, 100ml G40 entsprechen 40g Glucose.)
Bewusstlose Kinder mit gesichertem Venenzugang (Rücklaufprobe!): 0,2g/kgKG (= 1 mL/kgKG Glucose 20%)
Anwendungsgebiete
Intensivstation:
Auf Intensivstationen werden BGAs besonders häufig genutzt. Hier werden alle Parameter in Zusammenschau der restlichen Befunde bewertet und auch die (invasive) Beatmung anhand der regelmäßigen BGAs gesteuert. Bei der Interpretation kann Euch der Algorithmus „arterielle BGA“ helfen.
OP/Schockraum:
Im operativen Setting ist es durch regelmäßige BGAs möglich bei kritisch kranken Patient*innen, oder großen operativen Eingriffen, die Beatmung und Sauerstoffversorgung zu überwachen, den pH-Wert zu bestimmen, mögliche Elektrolytverschiebungen zu detektieren und im Zweifelsfall auszugleichen und sich einen groben Eindruck über den Verlauf des Hämoglobinwertes zu machen. CAVE: Bei einer akuten Blutungssituation kann der Hb trotz Blutung normwertig sein und erst im Verlauf abfallen!
Zusätzlich gibt der Verlauf des Lactates einen Anhaltspunkt über die Perfusion des Gewebes. Gleiches gilt auch für eine BGA, welche im Schockraum sozusagen zur Begrüßung des Patienten/der Patientin durchgeführt wird.
Präklinik (Betz et al.):
Da immer wieder diskutiert wird, ob eine BGA im präklinischen Setting sinnvoll sein kann, möchten wir Euch dazu hier kurz ein paar Aspekte zusammenfassen, die von den Kolleg*innen Betz et al. veröffentlicht wurden. Allerdings soll dies keine Generalempfehlung zur Nutzung einer BGA bei jeder Person sein, sondern lediglich Bereiche aufzeigen, wo wir durch die BGA eine differenziertere Therapie machen können.
Das klassische B-Problem:
Eine akute respiratorische Insuffizienz erkennen zu können, gehört zum Standard des notfallmedizinischen Personals und stellt in aller Regel niemanden vor große Probleme. Was sich allerdings schwieriger gestalten kann, ist die Pathogenese des B-Problems zu erkennen. Hierbei kann man unter anderem zwischen einer hyperkapnischen und einer hypoxämischen Form der akuten respiratorischen Insuffizienz unterscheiden, was die weitere (medikamentöse) Therapie durchaus verändern kann.
Die Arbeit von Betz et al. beschreibt, dass die häufigste Ursache einer CO2-Erhöhung die Exazerbation einer COPD ist. Hierbei zeigt sich in der Regel eine respiratorische Azidose mit pH-Werten von <7,35. Der pH-Wert und auch Bicarbonat sind sowohl in einer arteriellen, wie auch in einer venösen Messung vergleichbar. Hyperkapnische Zustände, egal ob durch eine Obstruktion (COPD, Asthma) oder eine Restriktion (Pneumothorax, Lungenfibrose) bedingt, können also angezeigt werden. Eine differenzierte Betrachtung des venösen CO2 wird aber in der Fachliteratur kontrovers diskutiert.
Bei einem hypoxämischen Lungenversagen (Lungenödem, Lungenarterienembolie, Pneumonie) gestaltet sich die Interpretation einer venösen BGA allerdings schwieriger, weshalb hier in Einzelfällen auch eine arterielle BGA indiziert sein kann. Allerdings ist der häufigste Grund ein interstitielles Lungenödem auf dem Boden einer akuten Linksherzdekomenpensation. Dies kann durch ein koronarischämisches Ereignis ausgelöst sein und neben einer schlechten Oxygenierung auch mit zusätzlichen pathologischen Zeichen der Ischämie, wie zum Beispiel einer Lactaterhöhung, oder einer metabolischen Azidose einhergehen. Hierbei sind die Lactatwerte in einer venösen und einer arteriellen BGA wieder akzeptabel vergleichbar. Es ist zu beachten, dass hohe Lactatwerte bei einer kardialen Dekompensation nicht zwingend mit einem schlechten Outcome assoziiert sein müssen.
Hinweisend für eine Lungenarterienembolie – natürlich eine vollständige Zusammenschau der Klinik und der Vitalparameter vorausgesetzt – kann die Konstellation aus erniedrigtem Sauerstoffpartialdruck, Hypokapnie und einer hyperventilationsbedingten Alkalose sein. Hier scheint aber die BGA ihre Lücken zu haben, da diese in bis zu 20% der Fälle unauffällig ausfallen kann.
Auch die Einstellung der nicht-invasiven Beatmung kann laut der Autor*innen mittels BGA genauer geschehen: Liegt ein ventilatorisches Versagen mit hohen pCO2-Werten vor, ist eine druckunterstützte NIV ohne erhöhte PEEP-Einstellung (laut Betz et al. nicht oberhalb des Intrinsic-PEEP), also CPAP/ASB oder BIPAP, von Vorteil. Eine gestörte Oxygenierung bei einem hypoxämischen Versagen sollte jedoch mit einer vermehrten Rekrutierung von Atelektasen einhergehen, was sich unter anderem mit einer höheren PEEP-Einstellung mittels CPAP ohne (oder nur mit geringer) Druckunterstützung erreichen lässt.
Die Überwachung einer NIV-Therapie mittels etCO2 wird – wie auch bei der kontrollierten Beatmung – als obligat angesehen.
Das C-Problem:
Eine akute Kreislaufdepression kann vielerlei Ursachen, wie zum Beispiel eine kardiale Genese haben. Eine der reversiblen Ursachen einer Reanimation ist die Hyperkaliämie, die unter anderem durch die Einnahme von vielen Medikamenten und bestehenden Komorbiditäten ausgelöst sein kann. In der klinischen Untersuchung von wachen Patient*innen zeigen sich bei einer Hyperkaliämie nur unspezifische Symptome, wie Herzrhythmusstörungen. Durch eine BGA sind solche Elektrolytverschiebungen schnell detektiert und können im Zweifel auch schon präklinisch behandelt werden.
Auch kann die Erhebung des Lactatwertes in der Notfallmedizin von Nutzen sein, da sich hieraus ein Zeichen des Sauerstoffmangels durch Hemmung der aeroben Glykolyse zeigt und für eine verminderte Gewebe- und Endorganperfusion – vor allem im Schock – spricht.
Differenzialdiagnostisch muss bei Zeichen eines akuten Abdomens und einer Lactaterhöhung auch immer an eine intestinale Ischämie gedacht werden.
Das D-Problem:
Hierbei ist vor allem der Stellenwert des Blutzuckers zu nennen, der sicherlich durch ein einfaches Messen mit herkömmlichen Methoden ebenfalls sehr schnell zur Verfügung steht. Neben dieser Bestimmung ist auch die Messung des Natriumwertes in der BGA durchaus relevant, um ein neurologisches Defizit z.B. aufgrund einer Hyponatriämie – die zu einer der häufigsten Elektrolytentgleisungen gezählt wird – ausschließen zu können. CAVE: Ein schneller Ausgleich einer Hyponatriämie verbietet sich aufgrund der Gefahr einer pontinen Myelinolyse. Eine unspezifische Lactaterhöhung kann in Zusammenschau der Klinik auch für ein stattgehabtes generalisierte Krampfgeschehen sprechen.
Sonstiges:
Weitere Werte. die auch für die Präklinik von Interesse sein können: Hb-Wert (vorbestellende Anämie/ Verlauf?), Kreatinin (prärenales Nierenversagen bei Exsikkose, Kumulation von Opiaten bei eingeschränkter Nierenfunktion)
Wichtig ist aber bei aller Euphorie über eine präklinische BGA, dass sie bei einer Indikation eines zügigen Transportes, diesen nicht verzögern sollte.
Spezielle Fragestellungen:
Drainagenblut:
Nimmt man zum Beispiel aus einer Thoraxdrainage Blut für eine BGA ab, ist es möglich den Hb dieses Blutes zu bestimmen, um herauszufinden, ob es sich um eine akute Blutung handelt. Hierbei ist ebenfalls ein kurzer Blick auf die Oxymetrie möglich, wobei man bei einer arteriellen Thoraxblutung vermutlich andere „Probleme“ haben wird.
Liquor:
Man kann eine Bestimmung von Glucose im Liquor machen, um in einem Point-of-care-Verfahren herauszufinden, ob der Glucose-Gehalt reduziert ist, was für eine Infektion mit Bakterien oder Pilzen sprechen würde. (Normalwert: 50-60% der Serumglucose).
Algorithmus

Autor*innen:
Dr. med. Thorben Doll
Dr. med. Dana Maresa Spies
Disclaimer
Der Inhalt sollte nicht als medizinischer Rat verstanden werden. Obwohl wir alle Anstrengungen unternehmen, um sicherzustellen, dass die von uns geteilten Informationen korrekt sind, freuen wir uns über Kommentare, Vorschläge oder Korrekturen von Fehlern. Datenschutz ist für uns von größter Bedeutung. Zahlen und Quellen sollten stets überprüft werden. Medizin unterliegt einem ständigem Wandel. Es wird keine Garantie für die Richtigkeit und Aktualität von Aussagen, Dosierungen oder Meinungen gegeben.
Wie immer vielen Dank an das Pin-up-docs-Team für die vielen guten Anmerkungen!
Quellen:
Nerdfallmedizin: https://nerdfallmedizin.blog/2018/09/22/bga-beurteilung/ und https://nerdfallmedizin.blog/tag/blutgasanalyse/
https://next.amboss.com/de/article/8l0OAT#Z40327eac3244bd11935bbf07c8db6fd5
„Die Anästhesie“ – Hans Walter Striebel 3. Auflage, ISBN: 978-3-7945-2942-1
Betz, S., Plöger, B. & Kill, C. D – Point of Care – Die präklinische Blutgasanalyse als diagnostisches Tool. Notfall Rettungsmed 20, 132–140 (2017). https://doi.org/10.1007/s10049-017-0270-1
Herold: Innere Medizin 2019, Kapitel V – Wasser und Elektrolythaushalt
S3-Leitlinie – Intravasale Volumentherapie bei Erwachsenen – AWMF-Registernummer 001 – 020
Gruber, Michael, Nehring, Carsten, Creutzenberg, Marcus, Graf, Bernhard and Hopf, Susanne. „Perchlorate (Irenat®) may falsely lower measured ionised calcium“ Clinical Chemistry and Laboratory Medicine, vol. 49, no. 6, 2011, pp. 1019-1024. https://doi.org/10.1515/CCLM.2011.160

Sind bei Sepsis nicht eher ERNIEDRIGTE statt erhöhte sO2-Werte in zentralvenöser und gemischvenöser Sättigung zu erwarten, da die O2-Ausschöpfung in der Peripherie erhöht ist? Im Test steht „… bei Sepsis eher erhöhte Werte…“.
Aber super Zusammenfassung mal wieder!
Hallo Peter,
natürlich sind Werte immer im Kontext zu verstehen und leider sind die Werte auch oft schwierig zu interpretieren, weshalb man da auch gern mal ins Schleudern kommt. 😉
Hier ist allerdings die Aussage der erhöhten scvO2 korrekt.
Der Hintergrund ist folgender:
In der Sepsis erfolgt eine verminderte Gewebsperfusion und dadurch eine Erhöhung der Shuntfraktion. Es kann also in der Peripherie weniger Sauerstoff ausgeschöpft werden, weshalb sich die zentral- bzw. gemischt-venöse Sauerstoff-Sättigung (vorausgesetzt die FiO2 bleibt gleich) erhöht.
Ich hoffe ich konnte es damit ausreichend erklären =) (Füge ich glaube ich in den Artikel zur besseren Verständlichkeit noch mit ein.)
Vielen Dank für deine Rückmeldung und wir freuen uns auch natürlich immer über das „Aufmerksam machen“ auf Fehler!
Liebe Grüße von den pin up docs,
Dana
Liebes Pin Up Team,
Vielen Dank für euren tollen Beitrag und vor allem auch diesem wunderbaren Artikel. Ich wurde in der DESAIC Prüfung BGA Messmethoden gefragt und konnte dank euch die Prüfer plätten 😊 vielen Dank und weiter so!!
Liebe Sarah,
das freut uns sehr! Herzlichen Glückwunsch zu deinem DESAIC-Erfolg!! 🙂
Toll, dass du deine Erfahrungen mit uns teilst!
Herzlichste Grüße,
Dana und die restlichen Pin up docs ☺️
Hey, lieben Dank für die tolle Zusammenfassung. Ist sehr gelungen. Ich bin Oberärztin auf einer grossen Intensivstation mit ECMO und habe noch mal mein Wissen vertiefen können.
Kennt ihr eine APP, wo man wirklich gut mit arbeiten kann, heisst: ich gebe die BGA Daten ein und die App gibt mir eine Interpretation wieder, vielleicht auch mit Erklärung. Gerade für unsere Assistenzärzte wäre das toll, aber auch für mich zum Validieren meiner Denkergebnisse 🙂 Man lernt ja nie aus.
Über Tipps wäre ich sehr dankbar.
Hallo Maike, vielen Dank für deine Rückmeldung.
Leider haben wir auch keine App gefunden, die bei der Auswertung behilflich sein könnte. Tut uns leid, da nicht helfen zu können..
Viel Erfolg weiterhin =)
Herzliche Grüße von den Pin-up-docs,
Dana