Basics – Einlungenventilation – ELV

Bei Operationen im Bereich des Thorax kann es euch passieren, dass der Operateur sich „wünscht“, dass nur ein Lungenflügel des Patienten beatmet wird. Auf diesem Weg entsteht im Bereich des nicht ventilierten (und meist vollständig kollabierten = Totalatelektase) Lungenflügels ein Raum, in dem der Chirurg seiner Lieblingsbeschäftigung, dem Operieren, nachgehen kann.
Für den Bereich der Thoraxchirurgie ist dieses Verfahren unumgänglich, aber auch bei anderen Operationen kann es nötig werden, zum Beispiel:
- Allgemeinchirurgie und Vizeralchirurgie
- „Zwei-Höhlen-Eingriffe“, meist am Ösophagus
- Unfallchirurgie und Orthopädie
- thorakale Wirbelsäulen-Eingriffe
- Herz- und Gefäßchirurgie
- thorakale Aorteneingriffe
Die Einlungenventilation (ELV) gehört somit ins Repertoire von vielen Anästhesisten. Es gibt allerdings einige Besonderheiten und Fallstricke, die man kennen sollte. Grund genug für uns, das Thema ein bisschen genauer zu beleuchten und euch einige praktische Hilfestellungen mit an die Hand zu geben.
Technik der ELV
Der Doppellumentubus ist mittlerweile der Goldstandard für die Lungenseparation. Die Alternative ist der Bronchusblocker, der nur noch bei einigen wenigen Situationen zum Einsatz kommt. Es gibt auch die Möglichkeit einer „zu tiefen“ Intubation. Das heißt, man intubiert mit einem konventionellen Tubus einen der beiden Hauptbronchien, und führt dadurch eine einseitige Ventilation herbei. Da letzteres Verfahren unseres Wissens nicht routinemäßig angewendet wird, wollen wir uns nur die beiden anderen Techniken genauer anschauen.
Doppellumentubus
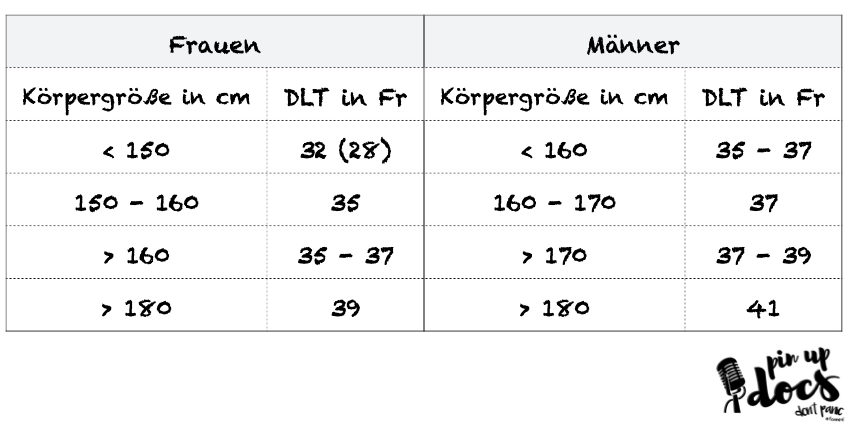
Doppellumentuben (DLT) stehen von verschiedenen Herstellern und in leicht unterschiedlichen Varianten zur Verfügung. Jeder DLT hat einen kürzeren trachealen (der proximal des bronchialen Cuffs endet) und einen längeren bronchialen Tubusschenkel (der distal des bronchialen Cuffs endet). Aufgrund des asymmetrischen Aufbaus (tracheobronchialer Winkel ist 25 – 30° rechts und 45° links) des Bronchialsystems werden rechtsseitige und linksseitige DLT unterschieden (Rechts- und Linksläufer).
Da der Abgang des rechten Oberlappens sehr proximal ist, ist der Rechtsläufer etwas schwieriger zu platzieren, da er eine zusätzliche Öffnung für den Oberlappen aufweist. Die kleine Öffnung verrutscht gerne und führt dadurch zu Beatmungsproblemen. Aus diesem Grund wird in vielen Kliniken mit Ausnahme von linksseitigen hilusnahen Operationen (linksseitigen Oberlappenresektionen und linksseitigen Pneumektomien sowie Mabschettenresektionen) der Linksläufer bevorzugt eingesetzt.

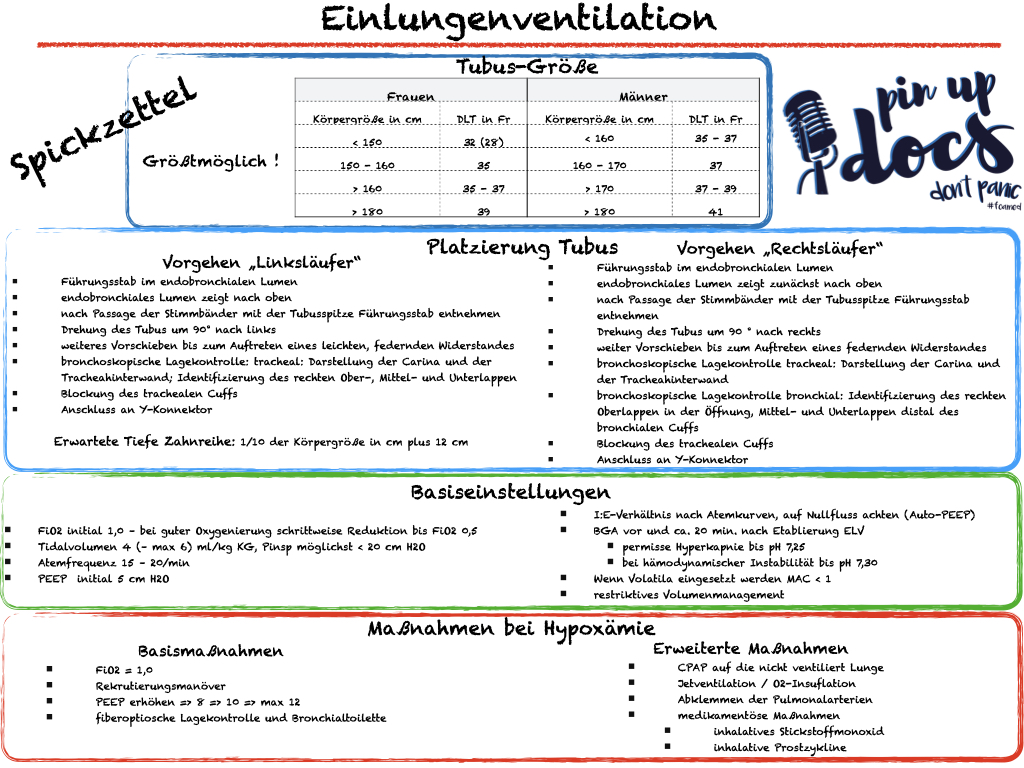
Die Größe des DLT wird anhand des Außendurchmessers in French angegeben. (Klugscheißerwissen: French und Charrière, sind die gleiche Maßeinheit – French ist lediglich die in der englischsprachigen Literatur vorherrschende Name; wahrscheinlich weil die Engländer Charrière nicht aussprechen können). Nach Möglichkeit sollte jeweils der größtmögliche zu platzierende Tubus gewählt werden. Dadurch wird die Resistance des Atemweges erniedrigt und die Entwicklung von Auto-PEEP reduziert.
Neben dem am häufigsten verwendetem DLT, dem sog. Robertshaw Tubus, gibt es mit dem Carlsen- und White-Tubus noch Varianten mit einem sog. Carina Haken. Dieser soll zu einer besseren „Lagestabilität“ führen, erschwert aber als „Widerhaken“ das Einführen.
Zusätzlich existieren noch Varianten mit integrierten Kameras (zur kontinuierlichen Lagekontrolle) und Ventilen (zur Erzeugung der Totalatelektase ohne Abklemmen). Ihr solltet Euch in jedem Fall mit dem in Eurer Klinik gebräuchlichen Model vertraut machen.
Für tracheotomierte Patient:innen sind spezielle Doppellumentrachealkanülen verfügbar. Diese werden allerdings nicht flächendeckend vorgehalten.
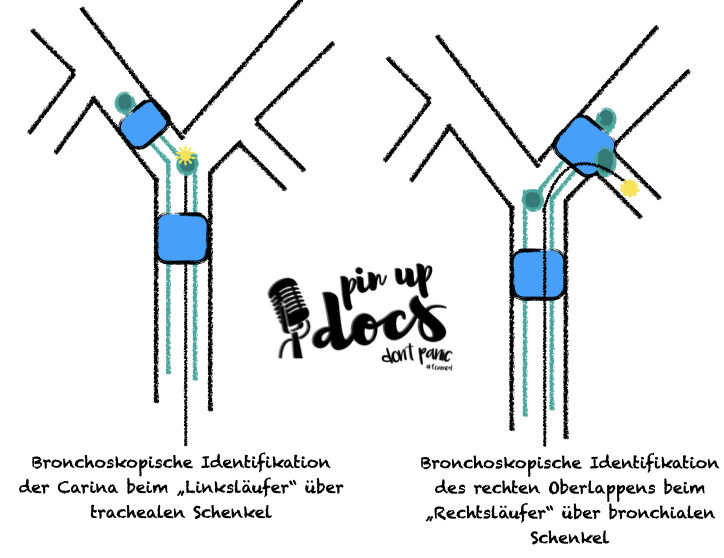
Egal welche Form ihr benutzt, eine fiberoptische Lagekontrolle ist obligat und sollte nach jedem Lagewechsel des Patienten wiederholt werden. Wir bevorzugen eine initiale Kontrolle über den trachealen Schenkel zur sicheren Darstellung der Carina und der Tracheahinterwand.
Vorgehen „Linksläufer“
- Führungsstab im endobronchialen Lumen
- endobronchiales Lumen zeigt nach ventral
- nach Passage der Stimmbänder mit der Tubusspitze Führungsstab entnehmen
- Drehung des Tubus um 90° nach links
- weiteres Vorschieben bis zum Auftreten eines leichten, federnden Widerstandes
- bronchoskopische Lagekontrolle: Darstellung der Carina und der Tracheahinterwand tracheal – Orientierung an Knorpelspangen; Identifizierung des rechten Ober-, Mittel- und Unterlappens
- Blockung des trachealen Cuffs
- Anschluss an Y-Konnektor
Vorgehen „Rechtsläufer“
- Führungsstab im endobronchialen Lumen
- endobronchiales Lumen zeigt nach ventral
- nach Passage der Stimmbänder mit der Tubusspitze Führungsstab entnehmen
- Drehung des Tubus um 90 ° nach rechts
- weiter Vorschieben bis zum Auftreten eines federnden Widerstandes
- bronchoskopische Lagekontrolle tracheal: Darstellung der Carina und der Tracheahinterwand
- bronchoskopische Lagekontrolle bronchial: Identifizierung des rechten Oberlappens in der Öffnung, Mittel- und Unterlappen distal des bronchialen Cuffs
- Blockung des trachealen Cuffs
- Anschluss an Y-Konnektor
Erwartete Tiefe Zahnreihe: 1/10 der Körpergröße in cm plus 12 cm
Auskultatorische Lagekontrolle
Neben der fiberoptischen Lagekontrolle ist eine auskultatorische Lagekontrolle möglich und war lange Zeit der Standard. Hierzu werden beide Cuffs geblockt. Im Anschluss werden die beiden Lumen nacheinander (ab-)geklemmt. Auf der (ab-)geklemmten Seite sollte jeweils kein Atemgeräusch auskultierbar sein. Außerdem kann, besonders bei schlanken Patienten, eine Abnahme der Atemexkursion auf der geklemmten Seite beobachtet werden.
CAVE: Diese Art der Lagekontrolle ist fehleranfällig und sollte nur ergänzend zum Einsatz kommen.
Bronchialer Cuff
Um Drucknekrosen zu vermeiden ist eine Cuffdruckkontrolle beider Cuffs obligat.
Liegedauer eines DLT
Aufgrund der hohen Steifigkeit und Länge des DLT im Vergleich zum herkömmlichen einlumigen Endotrachealtubus (ET) besteht ein erhöhtes Verletzungs- und Dislokationsrisiko. Daher sollte im Falle einer Nachbeatmung der DLT auf einen ET gewechselt werden.
Probleme bei der Platzierung des DLT
Problem: DLT lässt sich nicht über die Glottisebene vorschieben
Grund 1: Es handelt sich um einen schwierigen Atemweg
Lösung: Wechsel auf den Algorithmus schwieriger Atemweg (Pin-Up-Docs Basics Atemwegssicherung). Nach erfolgter Atemwegssicherung kann mittels Fiberoptik die Ursache identifiziert werden. Je nach Befund kann ein Wechsel vom „Rescue-Device“ auf einen DLT mittels Bougie oder anderem „Airway-Exchange-Device“ erfolgen.
Grund 2: der DLT ist zu groß für den Atemweg
Lösung: bei suffizienter Oxygenierung – Wechsel auf einen kleineren DLT. Bei insuffizienter Oxygenierung Wechsel auf den Algorithmus schwieriger Atemweg (Pin-Up-Docs Basics Atemwegssicherung).
Problem: der DLT lässt sich nicht richtig positionieren
Vorgehen: Fiberoptische Sicht über bronchialen Schenkel des DLT; zurückziehen des DLT bis die Carina sicher identifiziert werden kann; erneutes Einbringen unter Sicht. Anschließende Kontrolle über trachealen Schenkel (Carina sichtbar?). In vielen Fällen ist dies schon die Lösung des Problems.
Problem: der „Linksläufer“ lässt sich auch fiberoptisch nicht richtig positionieren
Grund: DLT zu groß
Lösung: Wechsel auf einen kleineren DLT
Grund: anatomische Besonderheiten der Carina
Lösungsmöglichkeiten: Wechsel auf einen kleineren „Linksläufer“; Wechsel auf einen „Rechtsläufer“; Verwendung eines Bronchusblockers.
Problem: Die Oberlappenöffnung des „Rechtsläufers“ lässt sich nicht richtig positionieren
Vorgehen: Fiberoptische Kontrolle über den trachealen Schenkel; Lage korrekt?, Cuff-Hernie? ggf. Lagekorrektur. Im Anschluss fiberoptische Kontrolle über den bronchialen Schenkel; richtige Positionierung der Öffnung ist häufig über Rotationsbewegungen und vorsichtiges Vor- und Zurückschieben möglich. Notfalls muss auf einen Bronchusblocker gewechselt werden.
Bronchusblocker
Ein Bronchusblocker besteht aus einem dünnen Katheter mit einem aufblasbaren Ballon am Ende. Das System gibt es ebenfalls von verschiedenen Anbietern. Sie können bronchoskopisch durch oder neben dem Tubus eingeführt werden um gezielt einen Haupt- oder Lappenbronchus zu blockieren.
Es gibt unseres Wissens keine Daten, die die Überlegenheit eines DLT gegenüber einem Bronchusblocker belegen, allerdings hat sich vielerorts, aufgrund der leichteren Anwendung (leichtere Platzierung, geringere Dislokationsgefahr), der DLT durchgesetzt. Es gibt aber ein paar Indikationen, bei denen man am Bronchusblocker nicht vorbei kommt:
- Kinder < 8 Jahren (größenabhängig)
- bereits intubierte Patienten mit
- bekanntem oder erwartet schwierigem Atemweg
- hoher Aspirationsgefahr
- Trachealstenosen
- (einliegende Trachealkanüle)
- relative Indikation – individuelle Abwägung
- anatomische Besonderheiten, die einen DLT unmöglich machen.
Physiologie und Pathophysiologie der ELV
Grundlagen
Wir sollten uns erneut die Asymmetrie der Thoraxorgane vergegenwärtigen. Der linken Lunge fehlt nämlich (in der Regel) das 7. Segment, daher hat sie auch etwas weniger Blutvolumen (stehend oder in Rücklage sieht dieses Verhältnis etwa so aus: 55% (rechte Lunge) zu 45% (linke Lunge).
Am eigentlichen Mechanismus des Gasaustausches ändert die ELV NICHTS. Er funktioniert nach einem Prinzip, das wir schon aus der Schule kennen: die gute alte Diffusion. Allerdings nimmt die Effektivität deutlich ab. Der paO2 sinkt nach dem „Klemmen“ einer Lunge unter einem FiO2 von 1,0 von etwa 400 mmHg auf 100-150 mmHg (Loop). Der Grund für dieses Phänomen ist recht einfach zu verstehen: Der gesamte Blutfluss durch die nicht ventilierte Lunge ist Shunt-Volumen (wird nicht oxygeniert) und somit je nach Seite 55 bzw. 45% des Blutflusses nicht mehr am Gasaustausch teilnehmen. Das CO2 bleibt aufgrund seiner besseren Diffusionseigenschaften von diesem Phänomen nahezu unbeeinträchtigt.
Lageabhängigkeit der Durchblutung
Wir sollten uns noch in Erinnerung rufen, dass die Lungendurchblutung lageabhängig ist (Zonen nach West und den Ventilations-Perfusions-Mismatch). Die meisten Operationen, bei denen eine ELV notwendig wird, werden dankenswerterweise in Seitenlage durchgeführt, in der die ventilierte Lunge unten liegt. Die unten liegende Lunge wird zum Glück auch mehr durchblutet, sodass allein die Lagerung unser Shuntvolumen vermindert. Das heißt, die Seitenlagerung ist bei der ELV nicht nur für den Zugangsweg der Operateure wichtig, sondern eine wichtige Maßnahme zur Verbesserung des paO2.
Euler-Liljestrand – AHOI; hypoxische pulmonale Vasokonstriktion
Der gute alte Euler-Liljestrand-Mechnismus rettet uns (den Arsch)! Der niedrige Sauerstoffpartialdruck in der atelektatischen Lunge führt zu einer Vasokonstriktion in den nicht ventilierten Bereichen. Dies wiederum führt zu einer Abnahme der Durchblutung in der abgeklemmten Lunge. Dieser Mechanismus führt zu einer Reduktion des Shuntvolumens um bis zu 40% (Lumb et al.; Lohser et al.) und verbessert damit den paO2.

Pathologische Faktoren die eine Hypoxämie begünstigen
Da es schon beim Lungengesunden zu einem relevanten Abfall des paO2 unter ELV kommt, können einige pathologische Veränderungen die ELV erschweren oder sogar unmöglich machen.
- Pleuraerguss
- Pneumonie
- Lungenfibrose
- kardiale Dekompensation mit Lungenödem
- Bronchospasmus
Kurzum: nahezu alle Erkrankungen, die eine respiratorische Partial- oder Globalinsuffizienz hervorrufen. Wenn die Dringlichkeit des geplanten Eingriffs das zulässt, sollten solche Pathologien im Vorfeld diagnostiziert und therapiert werden.
Anästhesiologisches Management
PEEP
Wir erinnern uns daran, dass es sich beim Lungenkreislauf um ein „Niederdruck-System“ handelt (Normwert pulmonalarterieller Druck: 15-28 mmHg). Aus diesem Grund befinden wir uns bei der PEEP-Einstellung in unserem ersten Dilemma. Auf der einen Seite wollen wir ein gewisses PEEP-Niveau haben, um Atelektasen in der untenliegenden ventilierten Lungen zu vermeiden und uns somit einen Teil unserer eh schon geschrumpften Gasaustauschfläche zu erhalten. Auf der anderen Seite führt ein hohes PEEP-Niveau zu einer Erhöhung des pulmonalarteriellen Widerstandes. Außerdem müssen wir uns zusätzlich noch vor Augen führen, dass der pulmonalarterielle Widerstand in der nicht ventilierten Lunge verhältnismäßig gering ist, da der Thorax auf dieser Seite ja meistens eröffnet ist. (Die Eröffnung des Thorax führt zu einer Zunahme der Compliance der nicht ventilierten Lunge und somit zu einer Abnahme des pulmonalarteriellen Widerstandes). Dies alles führt dazu, dass ein zu hoher PEEP zu einer Vergrößerung des Shuntvolumens und somit zu einer Verschlechterung der Oxygenierung führt (BoA.coach – Einlungenventilation; SOP – Helios; Loop) .
Empfehlung: Anfangs-PEEP von 5 cm H2O (bei Adipositas etwas höher). Bei unzureichender Oxygenierung Steigerung bis auf max. 12 cm H2O. Regelmäßige Kontrollen des Gasaustausches mittels BGA. PEEP-Level oberhalb von 12 cm H2O sollten kritisch hinterfragt werden und erscheinen nur in Einzelfällen sinnvoll.
PEEP der ventilierten Lunge initial 5 cmH2O; bei unzureichender Oxygenierung 8 ⇒ 10 bis maximal 12 cmH2O
FiO2
Bei der FiO2 befinden wir uns leider in einem ähnlichen Dilemma wie beim PEEP. Einerseits benötigen wir ein hohes FiO2 um eine ausreichende Oxygenierung mit einer „halben“ Lunge zu ermöglichen. Auf der anderen Seite birgt ein hohes FiO2 die Gefahr von Diffusionsatelektasen in unserer beatmeten Lunge. Während der ELV wird allgemein eine SaO2 > 92 % als ausreichend erachtet. Ausnahmen gelten für spezielle Situationen wie z.B. Patienten mit koronarer Herzerkrankung, die von einer Myokardischämie bedroht sind (Loop).
Empfehlung: Anfangs-FiO2 0,8 – 1,0 (je nach Oxygenierung in BGA unter Zweilungenventilation). Bei guter Oxygenierung kann eine Reduktion bis auf 0,5 erfolgen. Ziel ist ein paO2 von ca. 100 mmHg, da eine „Sauerstoffvergiftung“ (Hyperoxämie) die Gefahr von Sauerstoffradikalen birgt.

FiO2 initial 0,8- 1,0; bei guter Oxygenierung (> 100mmHg) schrittweise Reduktion bis FiO2 0,5
Tidalvolumen
Bei den Tidalvolumina ist es eigentlich wie immer: „So viel wie nötig, aber so wenig wie möglich.“ Leider kommt es im Rahmen von thoraxchirurgischen Eingriffen postoperativ gehäuft zu akutem Lungenversagen (Serpa et al.). Aber was heißt das jetzt konkret? Wir sollten Tidalvolumina von 4- max. 6 ml/kg KG und einen Pinsp < 30 cm H2O anstreben um Volu-/Barotrauma zu minimieren ( Lohser et al.; Loop).
Tidalvolumen: 4- max. 6 ml/KG kg
Pinsp: < 30 cm H2O
Atemfrequenz
Um trotz des eher niedrigen Tidalvolumens eine adäquate Descarboxylierung zu erreichen, benötigen wir bei der ELV tendenziell eine höhere Atemfrequenz. Eine (zu) hohe Atemfrequenz bringt leider aber auch eine hohe Totraumventilation mit sich. Atemfrequenzen zwischen 15-20/min haben sich in der Praxis bewährt (SOP – Helios).
Atemfrequenz: 15-20/min
I:E-Verhältnis
Aufgrund der höheren Atemfrequenzen (kurze Exspirationsphase) und des kleineren Einzellumens des DLT besteht die erhöhte Gefahr für eine unvollständige Exspiration und somit einer dynamischen Hyperinflation (Auto-PEEP). Wir müssen daher das I:E-Verhältnis so wählen, dass wir eine vollständige Exspiration ermöglichen.
I:E-Verhältnis nach Atemkurven, auf Nullfluss am Ende der Exspiration achten (Auto-PEEP)
Beatmungsmodus
Es gibt derzeit keine Studien, die die Überlegenheit eines Beatmungsmodus bei ELV zeigen konnten. Allerdings konnte unter PCV (pressure controlled ventilation) eine bessere Oxygenierung erreicht werden (Kim et al.). Aus diesem Grund und aus theoretischen Überlegungen (niedrigere Spitzendrücke) präferieren wir eine PCV.
Es gibt keine Evidenz für die Überlegenheit eines Beatmungsmodus. Wir präferieren eine PCV.
Rekrutierungsmanöver
Atelektasen können unsere technisch bedingt reduzierte Gasaustauschfläche weiter herabsetzen. Atelektasen führen bei gleichbleibendem Tidalvolumen zwangsläufig zu einer Überblähung der ventilierten Lungenabschnitte. Es konnte gezeigt werden, dass ein Rekrutierungsmanöver VOR Etablierung der ELV zu einer Verbesserung der Oxygenierung führt (Unzueta et. al.).
Rekrutierungsmanöver vor Etablierung der ELV verbessern die Oxygenierung.
Überwachung der Beatmung
Die Überwachung der Beatmung erfolgt mittels BGA, da das etCO2 aufgrund des Shuntvolumens nur eingeschränkt zu verwerten ist. Während der paO2 wie oben erwähnt beim „Klemmen“ der Lunge stark abfällt, bleibt das paCO2 aufgrund der besseren Diffusionseigenschaften konstanter.
Aus praktischen Überlegungen empfehlen wir eine BGA vor Etablierung der ELV und 20 min nach dem „Klemmen“. Weitere Kontrollen sollten je nach Gasaustausch in regelmäßigen Abständen erfolgen.
BGA vor und 20 min nach Etablierung der ELV
permissive Hyperkapnie
Um eine lungenprotektive Beatmung mit möglichst niedrigen Spitzendrücken (Pinsp < 30 cm H2O) zu ermöglichen ist eine permissive Hyperkapnie (pH > 7,25) statthaft. Im Falle einer Kreislaufinstabilität und damit einhergehender Katecholamingabe sollte ein pH > 7,30 angestrebt werden.
permissive Hyperkapnie: pH bis 7,25 tolerabel – bei hämodynamischer Instabilität pH > 7,30.
Narkoseverfahren
Die klassische Meinung, dass volatile Anästhetika die hypoxische Vasokonstriktion vermindern und somit vermieden werden sollen, stammen vorwiegend aus älteren tierexperimentellen Untersuchungen mit hohen MAC-Werten und älteren Anästhetika. (Karzai et al.). Neuere Beobachtungsstudien mit modernen Anästhetika belegen, dass MAC-Werte bis 1 die hypoxische Vasokonstriktion nicht klinisch relevant beeinflussen und genauso sicher sind wie eine TIVA (Lohser et al.).
Ein weiterer Aspekt ist die Arbeitsplatzbelastung, da es zu einer „Abatmung“ über die nicht ventilierte Lunge kommt (offener Schenkel am DLT/ eröffnete Lunge im OP-Gebiet).
Um die Abwägung noch komplexer zu machen gibt es Hinweise, dass volatile Anästhetika zu einer Reduktion der ALI (acute lung injury) führen (Lohser et al.). Es handelt sich leider lediglich um Hinweise, sodass die Größe dieses Effektes nicht sicher beurteilt werden kann.
Wenn Volatila eigesetzt werden erscheint ein MAC zwischen 0,5-1 sinnvoll.
Volumenmanagment
Im Rahmen einer ELV erscheint ein eher restriktives Volumenmanagement aus mehreren Überlegungen sinnvoll:
- „Überwässerung“ der ventilierten Lungen und somit Verschlechterung des Gasaustausches
- Anastomoseninsuffizienzen durch ein Gewebsödem
- Verminderung der HPV im Rahmen einer Volumenüberladung
restriktives Volumenmanagement anstreben!
Punchlines Basiseinstellungen
- FiO2 initial 1,0 – bei guter Oxygenierung schrittweise Reduktion bis FiO2 0,5
- Tidalvolumen 4 (– max 6) ml/kg KG, Pinsp möglichst < 20 cm H2O
- Atemfrequenz 15 – 20/min
- PEEP initial 5 cm H2O
- I:E-Verhältnis nach Atemkurven, auf Nullfluss achten (Auto-PEEP)
- BGA vor und ca. 20 min. nach Etablierung ELV
- permisse Hyperkapnie bis pH 7,25 – bei hämodynamischer Instabilität bis pH 7,30
- Wenn Volatila eingesetzt werden MAC < 1
- restriktives Volumenmanagement

Management einer persistierenden Hypoxämie
Eine persistierende Hypoxämie tritt in ca. 5-10% der Patienten auf (Karzai et al.). In diesen Fällen sollte ein strukturiertes Management erfolgen.
Basismaßnahmen
FiO2
Die erste Maßnahme im Rahmen einer Hypoxämie (SpO2 < 90%) im Rahmen einer ELV stellt ein FiO2 von 1,0 dar.
Rekrutierungsmanöver
Wenn die hämodynamische Stabilität des Patienten dies zulässt, kann ein Rekrutierungsmanöver die Oxygenierung verbessern (z.B. 3–5 sec dauerndes inspiratorisches Druckniveau von 25 – 35 cmH2O) (Tusman et al.).
PEEP
Eine Erhöhung des PEEP kann zu einer Verbesserung der Oxygenierung führen, kann aber auch das Shuntvolumen erhöhen (s.o.). Wir empfehlen eine stufenweise Erhöhung des PEEP im Falle einer Hypoxämie bis maximal 12 cm H2O.
Fiberoptische Lagekontrolle und Bronchialtoilette
Bei jeder Hypoxämie unter ELV sollte eine erneute Lagekontrolle und ggf. Korrektur des DLT erfolgen. Sollte im Rahmen dieser Lagekontrolle ein „Schleimproblem“ offensichtlich werden, empfiehlt sich die Therapie mittels Bronchialtoilette.
Erweiterte Maßnahmen
(intermittierende) Zweilungenventilation
Die einfachste Möglichkeit zur Verbesserung der Oxygenierung ist eine Aufhebung der ELV. Dieses sollte allerdings nur in enger Absprache mit den Chirurgen erfolgen, um Verletzungen durch die Ventilation zu vermeiden, außerdem macht es ein Operieren nahezu unmöglich.
CPAP auf die nicht ventilierte Lunge
Je nach Operation kann der Einsatz von CPAP auf die nicht ventilierte Lunge erfolgen. Letztendlich besteht dieses System aus einem Schlauch für die Frischgaszufuhr und einem Ventil zur Einstellung eines PEEP. Auf diesem Weg kann die Oxygenierung verbessert werden. Es hebt allerdings die Totalatelektase auf und führt je nach Compliance der Lunge zu einer zum Teil erheblichen Ausdehnung. Dies kann eine Fortsetzung der Operation erheblich erschweren oder sogar unmöglich machen (Russel). Eine Modifikation wäre die intermittierende CPAP-Applikation.
Jetventilation / Sauerstoff-Insufflation
Alternative Methoden wie eine hochfrequente Jetventilation, die Insufflation von reinem Sauerstoff über einen Katheter oder gezielt über das Bronchoskop sind weitere Möglichkeiten zur Verbesserung der Oxygenierung. Diese Maßnahmen erfordern allerdings einige Übung und haben ähnliche Nachteile wie eine CPAP-Applikation auf die nicht ventilierte Lunge.
Praxis-Tipp: Als einfache Maßnahme kann auch eine Applikation von Sauerstoff über eine Nasensonde in den Schenkel der nicht ventilierten Lunge erfolgen. Dies stört die Operateure oft wenig und lässt sich gut dosieren.
Abklemmen der Pulmonalarterien
Ein Abklemmen der Pulmonalarterien (oder Teile davon) der nicht ventilierten Lunge durch die Thoraxchirurgen kann das Shuntvolumen reduzieren und die Oxygenierung verbessern.
Medikamentöse Verbesserung der Oxygenierung
Inhalatives Stickstoffmonoxid oder inhalative Prostazykline sind medikamentöse Möglichkeiten eine Hypoxämie zu behandeln. Diese Interventionen sind allerdings Zentren Vorbehalten.
Punchlines Management einer persistierenden Hypoxämie
Basismaßnahmen
- FiO2 = 1,0
- Rekrutierungsmanöver
- PEEP erhöhen => 8 => 10 => max 12 cm H2O
- fiberoptiosche Lagekontrolle und Bronchialtoilette
Erweiterte Maßnahmen
- CPAP auf die nicht ventiliert Lunge
- Jetventilation / O2-Insuflation
- Abklemmen der Pulmonalarterien
- medikamentöse Maßnahmen
- inhalatives Stickstoffmonoxid
- inhalative Prostzykline

Autoren
Dr. med. Thorben Doll
Arzt in Weiterbildung Anästhesiologie, aktiver Notarzt, lernte die Notfallmedizin von der Pike auf kennen, präklinische Erfahrung 17 Jahre und Gründer von Pin-Up- Docs.de
Johannes Pott
Arzt in Weiterbildung Anästhesiologie, aktiver Notarzt, Lieblingsbaustelle ist die Intensivstation. Seit 16 Jahren im Rettungsdienst und Gründer von Pin-Up-Docs.de
Online Quellen
https://flexikon.doccheck.com/de/Diffusion
https://flexikon.doccheck.com/de/Charrière
https://flexikon.doccheck.com/de/Euler-Liljestrand-Mechanismus
https://flexikon.doccheck.com/de/Pulmonalarteriendruck
https://flexikon.doccheck.com/de/Totraumventilation
https://flexikon.doccheck.com/de/Minimale_alveoläre_Konzentration
https://ains.umg.eu/studium-lehre/podcast/episode-28-jet-ventilation/?L=0
Quellen
- Kammerer T, Speck E, von Dossow V. Anästhesie in der Thoraxchirurgie. Anaesthesist. 2016 Mai 4; 397-412.
- Larsen R. Anästhesie. 10. Auflage. Elsevier GmbH München; 2013: 1221-1242.
- Larsen R. Thoraxchirurgie. Anästhesie und Intensivmedizin in der Herz-, Thorax- und Gefässchirurgie. 8. Auflage. Springer-Verlag Berlin Heidelberg New York; 2012: 359- 417.
- Loop T, Spaeth J. Atemwegsmanagement in der Thoraxanästhesie mit dem Doppellumentubus [Airway Management in Thoracic Anesthesia with Double-Lumen Tube]. Anasthesiol Intensivmed Notfallmed Schmerzther. 2018 Mar;53(3):174-185. German. doi: 10.1055/s-0043-114678. Epub 2018 Mar 19. PMID: 29554710.
- Loop, T. „One-lung ventilation.“ ANASTHESIOLOGIE & INTENSIVMEDIZIN 61 (2020): 579-586.
- Lumb AB, Slinger P: Hypoxic pulmo nary vasoconstriction: physiology and anesthetic implications. Anesthesiology 2015;122:932–946
- Lohser J, Slinger P: Lung Injury After One Lung Ventilation: A Review of the Pathophysiologic Mechanisms Affecting the Ventilated and the Collapsed Lung. Anesth Analg 2015;121:302–318
- Serpa Neto A, Hemmes SN, Barbas CS, Beiderlinden M, Fernandez-Bustamante A, Futier E, Hollmann MW, Jaber S, Kozian A, Licker M, Lin WQ, Moine P, Scavonetto F, Schilling T, Selmo G, Severgnini P, Sprung J, Treschan T, Unzueta C, Weingarten TN, Wolthuis EK, Wrigge H, Gama de Abreu M, Pelosi P, Schultz MJ; PROVE Network investigators. Incidence of mortality and morbidity related to postoperative lung injury in patients who have undergone abdominal or thoracic surgery: a systematic review and meta-analysis. Lancet Respir Med. 2014 Dec;2(12):1007-15. doi: 10.1016/S2213-2600(14)70228-0. Epub 2014 Nov 13. Erratum in: Lancet Respir Med. 2014 Dec;2(12):e23. PMID: 25466352.
- Kim KN, Kim DW, Jeong MA, Sin YH, Lee SK. Comparison of pressure-controlled ventilation with volume-controlled ventilation during one-lung ventilation: a systematic review and meta-analysis. BMC Anesthesiol. 2016 Aug 31;16(1):72. doi: 10.1186/s12871-016-0238-6. PMID: 27581657; PMCID: PMC5007729.
- Karzai W, Haberstroh J, Priebe HJ. Effects of desflurane and propofol on arterial oxygenation during one-lung ventilation in the pig. Acta Anaesthesiol Scand. 1998 Jul;42(6):648-52. doi: 10.1111/j.1399-6576.1998.tb05296.x. PMID: 9689269.
- Karzai W, Schwarzkopf K. Hypoxemia during one-lung ventilation: prediction, prevention, and treatment. Anesthesiology. 2009 Jun;110(6):1402-11. doi: 10.1097/ALN.0b013e31819fb15d. PMID: 19417615.
- Unzueta C, Tusman G, Suarez-Sipmann F, Böhm S, Moral V. Alveolar recruitment improves ventilation during thoracic surgery: a randomized controlled trial. Br J Anaesth. 2012 Mar;108(3):517-24. doi: 10.1093/bja/aer415. Epub 2011 Dec 26. PMID: 22201185.
- Tusman G, Böhm SH, Sipmann FS, Maisch S. Lung recruitment improves the efficiency of ventilation and gas exchange during one-lung ventilation anesthesia. Anesth Analg. 2004 Jun;98(6):1604-9, table of contents. doi: 10.1213/01.ane.0000068484.67655.1a. PMID: 15155312.
- Russell WJ. Intermittent positive airway pressure to manage hypoxia during one-lung anaesthesia. Anaesth Intensive Care. 2009 May;37(3):432-4. doi: 10.1177/0310057X0903700316. PMID: 19499863.

Pingback: Podcast April 2021 - Folge - pin-up-docs - don't panic
Hi ihr zwei,
und wieder einmal herzlichen Glückwunsch zu einem grandiosen Artikel! Hab ich umgehend an den zuständigen Oberarzt in der Thoraxanästhesie weiter geleitet für die dort eingesetzten Assistenten.
Ich hoffe, ihr verzeiht mir die häufigen Kommentare, natürlich hab ich auch zur ELV einen ;-)):
Ich finde es total wichtig, dass die bronchoskopische Lagekontrolle erst nach der OP-Lagerung erfolgt. Gerade bei Umlagerung in Seitenlage (ja häufig bei Lungeneingriffen) kann sich die Tubuslage schon nochmal ordentlich verändern. Dann hilft es so gar nicht, wenn man die Lage nur direkt nach der Einleitung kontrolliert hat. Im Stress von Umlagerung, Strippen sortieren, Narkose vertiefen für Schnitt usw geht die endgültige Lagekontrolle gern unter… die auskultatorische Kontrolle ist sicherlich nicht so genau, aber aus meiner Erfahrung eine gute Chance zu probieren, ob man die Technik des Tubus und den Sinn der zwei Cuff verstanden hat ;-))
Vielen Dank Euch & ein schönes Wochenende!
Grüße aus Nürnberg
Chris
Hey Chris,
du musst dich nicht für die Kommentare Entschuldigen (so wollen wir das ja!)
Ich gebe dir absolut recht! Wir machen 2x Lagekontrolle einmal direkt nach Intubation und einmal nach der Lagerung. Werden das nochmal betonen!
Danke für deine rege Beteiligung
Liebe Grüße aus Hannover
Thorben
Pingback: "titriert" Einlungenventilation - pin-up-docs - don't panic
Hallo Ihr beiden,
hat etwas gedauert, ich habe auch noch etwas:
Die Kanadier haben eine Notfallcheckliste für den Thorax Saal, die Checklisten sind so noch nicht komplett in eGENA eingearbeitet, kommen noch. Bis dahin hier der Free-Fulltext Link, ist recht praktisch und behandelt alle relevanten Notfälle bei OPs im Thorax.
https://cumming.ucalgary.ca/sites/default/files/teams/35/Thoracic%20Crisis%20Manual%20(1).pdf
https://cumming.ucalgary.ca/departments/anesthesiology/sections/thoracic-anesthesia
Viele Grüße
Mark