Von-Willebrand-Syndrom (vWS)

Fallbeispiel:
Ein 3-jähriges Mädchen wird in die zentrale Notaufnahme gebracht mit unstillbaren Nasenbluten. Die Mutter erzählt, dass dieses nun schon das 3. Mal in den letzten 6 Monaten ist, dass sie hier sind. Zudem fallen immer wieder blaue Flecken auf, obwohl die Kleine gar nicht so häufig fällt oder sich auch nicht stößt. Die Familienanamnese ist leer.
Epidemiologie:
Häufigste plasmatische Blutgerinnungsstörung (1% der Bevölkerung). 800/100.000 Personen; symptomatisch 12,5/100.000, schwerer Verlauf <0,3/100.000 mit quantitativen oder qualitativen Störungen des von Willebrand-Faktors (vWF)
Autosomal-dominant vererbbar (selten autosomal rezessiv)
Symptome:
Schleimhautblutungen, vermehrtes Nasenbluten, verstärkte Regelblutung, Nachblutungen nach Operationen v.a. in HNO-Bereich und nach Zahnextraktionen, schwere Verlaufsform mit Gelenkblutungen ähnlich der Hämophilie A/B
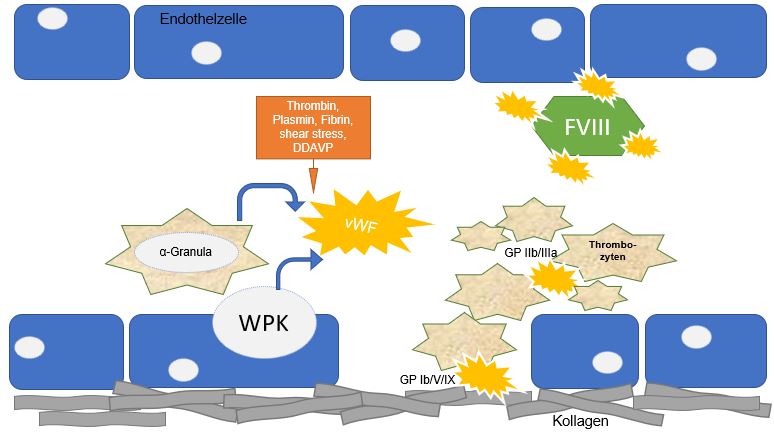
Von-Willebrand-Faktor (vWF):
Größtes Molekül, größtes Blutprotein mit den Funktionen:
1) Thrombozyten-Kollagen-Bindung
2) Carrierprotein für Faktor VIII
Andere: Neovaskularisierung, Inflammation
Herkunft: aus Endothelzellen (Weibel-Palade-Körper) und Megakaryozyten (α-Granula) Ausschüttung nach Stimulation (z.B. shear-stress, DDAVP)
Verdachtsdiagnose:
- positive Blutungsanamnese -> Score
- Familienanamnese
Sicherung der Diagnose
- Labortestung:
Globalteste häufig normal (Quick/INR, aPTT, Thrombozytenzahl), schwerer Verlauf aPTT-verlängert, Faktor VIII ggf. verringert
- Spezifische Testung:
vW-Antigen: Quantitative Störungen
Funktionstest: Kollagenbindung: selten gestört
Plättchenbindung: Ristocetin-Aktivitätstest
Blutgruppentestung
Subtypentestung mit Multimeranalyse
Im Rahmen von größeren elektiven Eingriffe, sollte bei dem entsprechenden Verdacht der Eingriff verschoben und eine Überweisung zur Hämostaseologie bzw. zum Hämostaseologen erfolgen.
Da es sich bei dem von Willebrand-Faktor um ein sogenanntes „Akutphasenprotein“ handelt erfolgt im Rahmen von Infekten bzw. Stresssituationen physiologischerweise eine Hochregulation des von Willebrandfaktors. Hierdurch kann ein von Willebrand-Syndrom sich kurzfristig der Diagnostik entziehen.
Merke:
Eine gesicherte Diagnose ist ein wesentlicher Schutz des Klinikers vor möglichen Komplikationen und Regressen, insbesondere bei Einsatz von (meist hochpreisigen) Faktorenkonzentraten.
Einteilung:
| Von Willebrand Typ | Zugrunde liegende Störung | Besonderheiten |
| Typ 1 | Quantitative Störung (vWF vermindert) | 60-80% der Fälle |
| Typ 2 | Qualitative Störung (Einteilung in Untergruppen) | 15% der Fälle |
| Typ 3 | Vollständiges Fehlen vWF | <5% der Fälle |
| erworben | Shear Stress (Aortenklappenstenose) Lymphatische Erkrankungen (Malignes Lymphom), MGUS; Autoimmunologisch (IgA-Nephritis, SLE) Medikamentennebenwirkung (Valproinsäure) | Therapie der Grunderkrankungen häufig die Behandlung, Substitution manchmal nötig |
Therapie:
Medikamente meiden, die die Thrombozytenfunktion beeinträchtigen (ASS, NSAR)
Nahrungsergänzungsmittel meiden: z.B. Gingko, Bromelin können ebenfalls eine Blutungsneigung verstärken
Hormonelle Kontrazeption zur Verminderung der Regelblutung unter Umständen sinnvoll (Kupferspirale eher kontraindiziert)
DDAVP (Desmopressin©, Vasopressin, ADH, Minirin©): triggert die Ausschüttung von vWF, hemmt zudem die Harnproduktion, führt dadurch zur Wasserretention und Hyponatriämie KI: Nicht bei vWS Typ 2 B anwenden (Thrombopeniegefahr bei Ausschüttung von hochmolekularen Molekülen), Epilepsie Tachyphylaxie bei wiederholten Gaben (nach 2-4d). Kopfschmerzen und Flush häufigste Nebenwirkung, zudem. Konjunktivitis, Fieber, Epistaxis, RR-Abfall CAVE: Indikationsstellung bei Kindern mit geringem KG (Flüssigkeitsüberladung), älteren Herz/Gefäßkranken (Ischämiegefahr). Vorher Testung der vWF-Ausschüttung, auch in Schwangerschaft möglich. DDAVP stimuliert die Fibrinolyse. Daher ggf. in Kombination mit Tranexamsäure sinnvoll.
Substitution: vWF oder Kombinationspräparat mit Faktor VIII. Bei Typ 3 in regelmäßigen Abständen nötig. Eine Einheit Faktor VIII/von Willebrand-Faktorkonzentrat pro kgKG erhöht die Plasmakonzentration um ca. 2 %. Bei massiven oder lebensbedrohlichen Blutungen ohne Möglichkeit der Gerinnungsdiagnostik 40-70 IE/kgKG empfohlen.
Tranexamsäuregabe: lokal, peroral, i.v., (Erw.: 3x1g/d, Ki: 10mg/kg KG)
Lokale Blutungskontrolle (hochlagern, Kompressionsverbände, lokale Hämostyptika)
Peripartal:
Merke:
Während der Schwangerschaft tritt physiologischerweise eine Hochregulation des von Willebrandfaktors auf, wodurch peripartal (insbesondere beim von Willebrand-Syndrom Typ 1) meist keine erhöhte Blutungsneigung die Folge ist. Man hat immer 2 Patienten (Mutter und Kind, ggf. beide substituieren), Typ 1: Spontanpartus, Typ2/3 evtl. Sectio
CAVE: Regionalanästhesie kritisch (Individualentscheidung, Typ 3 keine Regionalanästhesie vWF nur im Plasma aber nicht in Thrombozyten messbar, nicht kalkulierbar)
Substitution ggf. 3-5 Tage nach Geburt nötig, wenn der Faktor wieder herunterreguliert ist.
Verspätete Nachblutungen/Hämatome im Geburtskanal möglich. Daher engmaschige Nachbetreuung nötig.
Cave:
Postpartal besteht immer ein massiv erhöhtes thromboembolisches Risiko, gegebenenfalls unter Substitution zusätzlich eine medikamentöse Thromboseprophylaxe mit niedermolekularen Heparin indiziert. Individualentscheidung!
Besonderheiten:
Patienten mit Angiodysplasien im GI-Trakt (double hit: vWF-Mangel und Neovaskularisierungsstörungen, Substitution eher nötig)
Thromboseprophylaxe (gut substituierte Patienten mit Risikofaktoren können antikoaguliert) werden.

Im Notfall:
- Notfallausweis beachten (Form des vWS, Schweregrad der Störung übliche Substitution etc.)
- Betreuenden Gerinnungsmediziner kontaktieren oder Konsilarzt, ggf. perioperatives Gerinnungsmanagement (Substitutionsplan) erstellen lassen
- orientierend Faktor VIII-Spiegel bestimmen lassen (kann fast jedes Haus, dauert nicht solange wie komplettes vWS-Labor)
- elektiv präoperativ vWF-Aktivität (vWF:RiCoF, vWF:GP1b) > 50% anpeilen
- Leichte Form: DDAVP i.v. (NW und KI beachten)
- Substitutionsschema verfügbar? Genug Faktorenkonzentrate verfügbar ?
- Verlängerte und intensivere Nachbeobachtung: Pflegekräfte instruieren post-OP auf Blutungszeichen achten.
- CAVE: Analgetika nach OP, NSAR auch Thrombozytenfunktionsbeeinträchtigend.
Folgende Analgetika sind zu bevorzugen : Paracetamol, Metamizol (Novalgin), COX-2-Hemmer möglich, Opiate.
- Lagerungsschaden in OP möglich
Im Rettungsdienst:
- Bei Verletzungen/Erkrankung, nebst der Medikamentenanamnese, Blutungsneigung direkt ansprechen
- Notfallausweis einstecken, ggf. Substitutionspräparate mitnehmen. Lokale Blutungsmaßnahmen, Tranexamsäure.

Referenzen:
Fries, Streif Gerinnungsmanagement in der Intensivmedizin, Springer 2014
Bruhn, Hach-Wunderle, Schambeck, Scharf Hämostaseologie für die Praxis 2. Auflage, Schattauer 2011
Helmut Tschulik et. al; Gerinnung im klinischem Alltag, Auflage 7, Interdisziplinäre Gerinnungsgruppe Steiermark
AWMF Leitlinie- Thrombozytopathien Therapie 2014
M. Spannagl, Willebrand-Jürgens-Syndrom Anaesthesist 3 2001
https://www.springermedizin.de/willebrand-juergens-syndrom/8007250
M. Keller, H. Magunia, Perioperative Gerinnungsstörungen, Diagnostik und Therapie AINS 2019, 54:386-401
https://www.thieme-connect.de/products/ejournals/abstract/10.1055/a-0757-2375
Lier H., Mark M., Notaufnahme: Management starker Blutungen Notaufnahme up2date 2019,1:47-63
Lingohr P. et al. Perioperatives Management bei Patienten mit Hämophilie A und B sowie Von-Willebrand-Syndrom, Allgemein und Viszeralchirurgie Up2Date 2013
https://www.thieme-connect.de/products/ejournals/abstract/10.1055/a-0926-0978
Autoren:
Ines Severloh
Dr. Thomas Lang
Dr. Alexander Hanke

Pingback: Podcast April 2020 - Folge 15 - pin-up-docs - don't panic
Pingback: "titriert" Von-Willebrand-Syndrom - pin-up-docs - don't panic