PPI-Prophylaxe auf der Intensivstation für jedermann ?

Oder auch Pantoprazol… die eierlegende Wollmilchsau?
Seit ca. 2 Jahrzehnten bekommt so ziemlich jeder Patient auf der Intensivstation, ja wenn nicht sogar im ganzen Krankenhaus, einen Protonenpumpeninhibitor (PPI) zur Prophylaxe eines Stressulcus und damit einer oberen Gastrointestinalen Blutung. Aber ist das überhaupt notwendig? Kann man PPI wie Bonbons verschreiben weil Sie so nebenwirkungsarm sind?
Neuere Studienergebnisse zeigen auf, dass zumindest ein Mindestmaß an Skepsis angebracht ist.
Inzidenz von Stressulcera
Führt man eine ÖGD (Ösophagogastroduodenoskopie / Magenspiegelung) bei Intensivpatienten, nach schwerem SHT oder nach Verbrennungsverletzungen, innerhalb von 72 Stunden nach Aufnahme durch, so finden sich bei mehr als 75 % dieser Patienten Veränderungen der Magenschleimhaut im Sinne von Ulcerationen. Eine signifikante GI-Blutung entwickeln 1,5 bis 8,5 % aller Intensivpatienten [1], diese Zahl kann auf bis zu 15 % ansteigen, wenn die Patienten keine Stressulcus-Prophylaxe erhalten. Grund genug eine Prophylaxe anzustreben, oder nicht ?
Aber womit überhaupt ?
Zur Stressulcus-Prophylaxe eignen sich prinzipiell unterschiedliche Substanzen:
- PPI (Protonen-Pumpen-Inhibitoren)
- H2-Blocker
- Sucralfat
Alle drei führen zu einer Reduktion von GI-Blutungen. Auch wenn keines zu einem Risiko von Null führt, konnte gezeigt werden, dass PPI am effektivsten sind. [2] [3].
Die Standard-Dosis für das PPI Pantoprazol liegt bei bei 40 mg täglich. Bei Hochrisikokonstellationen, wie z.B. nach vorangegangener GI-Blutung, sind auch höhere Dosierungen möglich.
Aber auch enterale Ernährung schützt vor Stressulcera und kann entweder ergänzend oder sogar anstelle von einer medikamentösen Prophylaxe durchgeführt werden.
Wer sollte eine Stressulcusprophylaxe erhalten ?
Diese Frage ist leider nicht ganz einfach zu beantworten, ein paar Aussagen lassen sich aber treffen:
- Grundsätzlich gilt, dass Patienten, die ein PPI in der Vormedikation haben, dieses auch im Rahmen eines intensivmedizinischen Aufenthaltes weiter bekommen sollten.
- Patienten, die eine duale Thrombozyten-Aggregationshemmung (DAPT) erhalten, sollten ebenfalls eine PPI-Prophylaxe erhalten [4].
- Je höher das individuelle Risiko für eine GI-Blutung desto mehr profitieren die Patienten von einer Prophylaxe. (Bei Patienten mit dem höchsten Risiko {> 8%} führen PPI zu einer Reduktion von GI-Blutungen um 3-5%; bei Patienten mit niedrigem Risiko {2%} lediglich um weniger als 1%.)
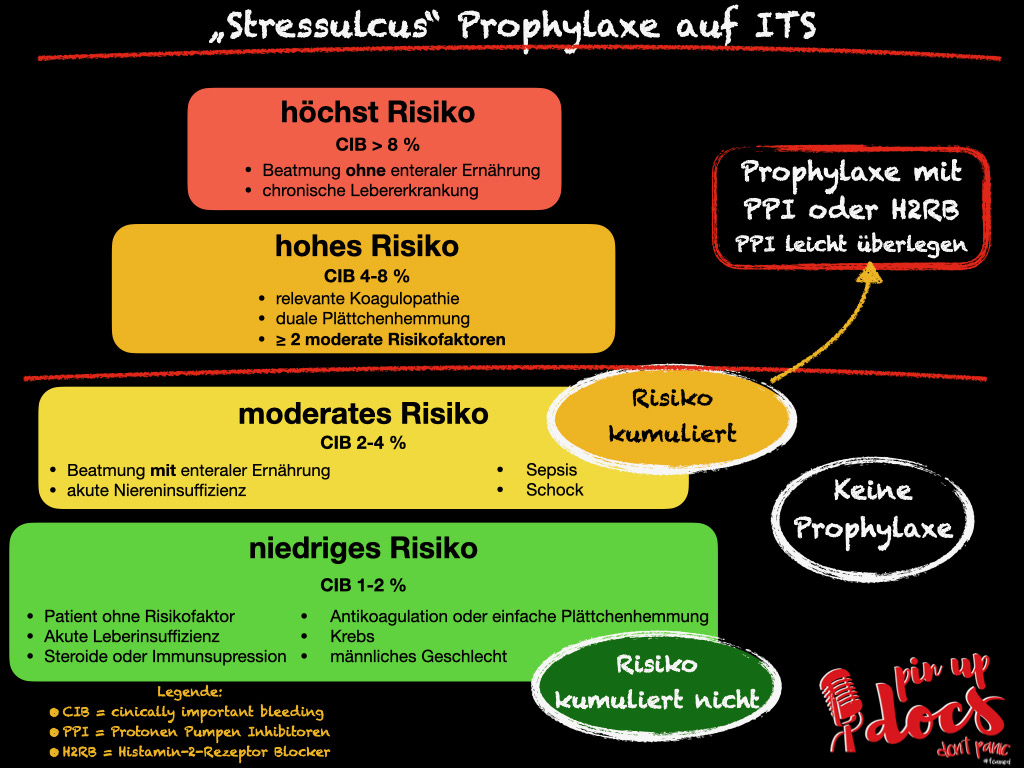
Um die Entscheidung zu vereinfachen teilen wir unsere Patienten in vier Gruppen ein:
- niedriges Risiko (1-2%)
- Patient ohne Risikofaktor
- Akute Leberinsuffizienz
- Steroide oder Immunsuppression
- Antikoagulation oder einfache Plättchenhemmung
- Krebs
- männliches Geschlecht
- moderates Risiko (2-4%)
- Beatmung mit enteraler Ernährung
- Akute Niereninsuffizienz
- Sepsis
- Schock
- Hohes Risiko (4-8%)
- relevante Koagulopathie
- > 2 moderate Risikofaktoren
- duale Plättchenhemmung
- höchstes Risiko (> 8%)
- Beatmung ohne enterale Ernährung
- chronische Lebererkrankung
In der Niedrig-Risikogruppe werden die einzelnen Risikofaktoren nicht kumuliert (das heißt, das Vorliegen von mehreren Risikofaktoren führt nicht zu einer Erhöhung des Risikos). In der moderaten Gruppe hingegen wird addiert (Patienten mit mehr als einem moderaten Risiko Faktor haben ein hohes Risiko) [5].

Aber warum bekommt nicht jeder eine PPI-Prophylaxe ?
Die Frage liegt auf der Hand! Besonders da eine PPI-Prophylaxe doch sicher und fast frei von Nebenwirkungen erscheint. Immerhin wird Pantoprazol (in Dosierungen bis 20 mg) doch auch rezeptfrei in der Apotheke verkauft.
Im intensivmedizinischen Setting wird immer wieder postuliert, dass eine PPI-Prophylaxe das Risiko von Clostrium difficile-Infektionen erhöht und die Inzidenz von Pneumonien steigt.
Dies lässt sich in bisher durchgeführten Studien nicht sicher belegen, es handelt sich bestenfalls um Trends.
Wir sehen ein zusätzliches Problem in der Fortführung einer PPI-Prophylaxe über den Intensivaufenthalt hinaus. Vielfach wird die PPI-Prophylaxe in die Dauermedikation übernommen und einfach nach Krankenhausentlassung weiter verordnet. Es sind einige Langzeitnebenwirkungen beschrieben:
- Abnahme der Knochendichte [10]
- evtl. Erhöhung des Herzinfarktrisikos [6]
- Steigerung des Demenzrisikos [7]
- erhöhte Inzidenz von Magenkarzinomen [8]
Allerdings werden auch diese Langzeitnebenwirkungen sehr kontrovers diskutiert. Andere Studien zeigen wiederum auf, dass eben diese Risiken nicht bestehen. [11]
Daher ist zumindest die Langzeitverordnung ohne wirkliche Indikation kritisch zu hinterfragen, was natürlich grundsätzlich für alle Medikamente gelten sollte.
Und was ist mit dem Überlebensvorteil ?
Eigentlich klingt es ja logisch, insgesamt weniger klinisch relevante GI-Blutungen müssen mit einem Überlebensvorteil für Intensivpatienten assoziiert sein.
Tja, leider ist das nicht so eindeutig. Im viel diskutierten PEPTIC-Trial [3] gab es sogar eine Übersterblichkeit von schwerkranken Patienten, die eine PPI-Prophylaxe erhielten. Auch im SUP-ICU-Trial zeigte sich eine ähnliche Tendenz [9].
Eine eindeutige Identifikation dieses Nachteils im Zusammenhang mit PPI gelingt hier aber nicht, gerade bei diesem Patientengut ist es sehr schwierig alle Cofounder auszuschließen.
Zusammenfassend kann man sagen, dass eine PPI-Prophylaxe keinen Überlebensvorteil bringt. Daten für eine erhöhte Mortalität scheinen aber nur auf definierte Subgruppen zuzutreffen und auch hier ist die Evidenzlage dünn.
Punchlines:
Die Kontroverse um die PPI-Prophylaxe wird uns noch lange beschäftigen, aber nehmt folgendes mit.

- der Standard-Post-OP-ITS-Patient benötigt KEINE PPI-Prophylaxe
- Das gilt auch für singuläre Steroid-Therapie
- Scannt die Entlassmedikation eurer Patienten auf überflüssige PPI-Verordnungen
- PPI ergeben Sinn wenn mindestens 2 moderate-Risikofaktoren vorliegen (vgl. Flow-Chart)
- PPI senken NICHT die Mortalität von Intensivpatienten
- Immer schön an die enterale Ernährung denken
- Diese Gedanken gelten natürlich auch für andere PPIs – die im Prinzip alle gleich wirken.
Autoren
Dr. med. Thorben Doll
Arzt in Weiterbildung Anästhesiologie, aktiver Notarzt, lernte die Notfallmedizin von der Pike auf kennen, präklinische Erfahrung 17 Jahre und Gründer von Pin-Up- docs.de
Johannes Pott
Arzt in Weiterbildung Anästhesiologie, aktiver Notarzt, Lieblingsbaustelle ist die Intensivstation. Seit 16 Jahren im Rettungsdienst und Gründer von Pin-Up-Docs.de
Quellen:
[1] https://litfl.com/stress-ulcer-prophylaxis/ (aufgerufen am 08.03.2021)
[3] The PEPTIC Investigators for the Australian and New Zealand Intensive Care Society Clinical Trials Group, Alberta Health Services Critical Care Strategic Clinical Network, and the Irish Critical Care Trials Group. Effect of Stress Ulcer Prophylaxis With Proton Pump Inhibitors vs Histamine-2 Receptor Blockers on In-Hospital Mortality Among ICU Patients Receiving Invasive Mechanical Ventilation: The PEPTIC Randomized Clinical Trial. JAMA. 2020;323(7):616–626. doi:10.1001/jama.2019.22190
[4] Bhatt DL, Cryer BL, Contant CF, Cohen M, Lanas A, Schnitzer TJ, Shook TL, Lapuerta P, Goldsmith MA, Laine L, Scirica BM, Murphy SA, Cannon CP; COGENT Investigators. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med. 2010 Nov 11;363(20):1909-17. doi: 10.1056/NEJMoa1007964. Epub 2010 Oct 6. PMID: 20925534.
[5] Ye Z, Reintam Blaser A, Lytvyn L, Wang Y, Guyatt GH, Mikita JS, Roberts J, Agoritsas T, Bertschy S, Boroli F, Camsooksai J, Du B, Heen AF, Lu J, Mella JM, Vandvik PO, Wise R, Zheng Y, Liu L, Siemieniuk RAC. Gastrointestinal bleeding prophylaxis for critically ill patients: a clinical practice guideline. BMJ. 2020 Jan 6;368:l6722. doi: 10.1136/bmj.l6722. PMID: 31907223.
[6] https://med.stanford.edu/news/all-news/2015/06/some-heartburn-drugs-may-boost-risk-of-heart-attack-study-finds.html (aufgerufen am 08.03.2021)
[7] Gomm W, von Holt K, Thomé F, Broich K, Maier W, Fink A, Doblhammer G, Haenisch B. Association of Proton Pump Inhibitors With Risk of Dementia: A Pharmacoepidemiological Claims Data Analysis. JAMA Neurol. 2016 Apr;73(4):410-6. doi: 10.1001/jamaneurol.2015.4791. PMID: 26882076.
[8] Cheung KS, Chan EW, Wong AYS, Chen L, Wong ICK, Leung WK. Long-term proton pump inhibitors and risk of gastric cancer development after treatment for Helicobacter pylori: a population-based study. Gut. 2018 Jan;67(1):28-35. doi: 10.1136/gutjnl-2017-314605. Epub 2017 Oct 31. PMID: 29089382.
[9] Krag M, Marker S, Perner A, Wetterslev J, Wise MP, Schefold JC, Keus F, Guttormsen AB, Bendel S, Borthwick M, Lange T, Rasmussen BS, Siegemund M, Bundgaard H, Elkmann T, Jensen JV, Nielsen RD, Liboriussen L, Bestle MH, Elkjær JM, Palmqvist DF, Bäcklund M, Laake JH, Bådstøløkken PM, Grönlund J, Breum O, Walli A, Winding R, Iversen S, Jarnvig IL, White JO, Brand B, Madsen MB, Quist L, Thornberg KJ, Møller A, Wiis J, Granholm A, Anthon CT, Meyhoff TS, Hjortrup PB, Aagaard SR, Andreasen JB, Sørensen CA, Haure P, Hauge J, Hollinger A, Scheuzger J, Tuchscherer D, Vuilliomenet T, Takala J, Jakob SM, Vang ML, Pælestik KB, Andersen KLD, van der Horst ICC, Dieperink W, Fjølner J, Kjer CKW, Sølling C, Sølling CG, Karttunen J, Morgan MPG, Sjøbø B, Engstrøm J, Agerholm-Larsen B, Møller MH; SUP-ICU trial group. Pantoprazole in Patients at Risk for Gastrointestinal Bleeding in the ICU. N Engl J Med. 2018 Dec 6;379(23):2199-2208. doi: 10.1056/NEJMoa1714919. Epub 2018 Oct 24. PMID: 30354950.
[10] Gasser, R.W. Protonenpumpeninhibitoren und Osteoporoserisiko. J. Miner. Stoffwechs. Muskuloskelet. Erkrank. 27, 2–7 (2020). https://doi.org/10.1007/s41970-019-00095-5

Pingback: "titriert" PPI in der Intensivmedizin - pin-up-docs - don't panic