(Erweitertes) hämodynamisches Monitoring und Volumen

Ein anästhesiologisches und intensivmedizinisches Thema, das immer wieder Kopfschmerzen bereiten kann, ist das der Volumentherapie. Zumindest ist das für mich eine durchaus große Herausforderung, denn schließlich wollen wir die Patientin/den Patienten nicht „überwässern“, aber natürlich auch keinen „Fisch“ auf dem Trockenen produzieren.
Mit diesem Artikel möchten wir Euch die Möglichkeiten aufzeigen, die uns vor allem in der Klinik gegeben sind, um den Volumenstatus der Patient*innen besser abschätzen zu können. Wir geben Euch einen Einblick über die einzelnen Parameter und versuchen „Licht ins Dunkle“, worin die Unterschiede liegen.
Fallbeispiel:
Wir beginnen mit einem Fallbeispiel, indem eine solche Evaluation sinnvoll sein könnte:
Ihr seid als Anästhesistin oder Anästhesist im OP und sollt eine thorako-abdominelle Ösophagusresektion bei einem Patienten mit einem Ösophaguskarzinom betreuen. Der Patient ist 68 Jahre alt und hat neben einer 1-Gefäß-KHK und einer Hyperlipidämie keine wesentlichen Vorerkrankungen. Präoperativ wurde bei dem Patienten im Rahmen eines ACS-Ausschluss (bei retrosternalen Schmerzen aufgrund des Ösophaguskarzinoms) auch zur Evaluation der kardialen Pumpfunktion eine transthorakale Echokardiografie durchgeführt. Hier zeigte sich eine gute LV-und RV-Funktion, eine EF von 60 % und keine Wandbewegungsstörungen wie auch keine Klappenvitien.
Ihr versorgt den Patienten perioperativ mit einem thorakalen Periduralkatheter (PDK), einem Doppellumentubus, einer Arterie, einem ZVK und einem Blasendauerkatheter.
Nachdem ihr in den Saal gefahren seid, wirkt sich das Aufspritzen eures PDKs auf die Hämodynamik aus und ihr beginnt neben der Katecholamintherapie auch mit einer Volumengabe – wohlwissend, dass sich genau dieses Volumen auch umverteilen und im weiteren Verlauf im schlimmsten Fall zu Problemen durch „aufgequollenes“ Gewebe an der Anastomose führen kann.
Wie aber schätzt man nun ab, wie viel Flüssigkeit adäquat und wie viel Flüssigkeit zu viel ist?
Anmerkungen und Erläuterungen:
Normalbereiche schwanken je nach Literaturangaben. Bitte hausinterne Richtwerte beachten!
Um dieses durchaus komplexe Thema verständlich in einem Artikel zusammenzufassen brauchen wir zunächst ein paar wichtige Abkürzungen, Erläuterungen und Bezeichnungen.
Indizierung
Zunächst ist es wichtig die Unterscheidung zwischen indizierten und nicht-indizierten Werten zu verstehen:
- Nicht-Indizierte Werte:
- Beziehen sich auf den absoluten Wert und haben keinen Bezug auf Körpergröße / Körpergewicht einzelner Patient*innen.
- Indizierte Werte:
- Indizierte Werte sind, bezogen auf den Bereich der Hämodynamik, auf die Körperoberfläche / oder zum Teil auch das Körpergewicht bezogen und bieten somit eine bessere Vergleichbarkeit.
- Dadurch erzielt man eine Vereinheitlichung und somit auch eine optimalere Interpretation der erlangten oder errechneten Werte.
Oft müssen zur Bestimmung der exakten Werte, Körpergröße und das Gewicht des Patienten oder der Patientin am hämodynamischen Monitor eingegeben werden, damit ein Bezug der hämodynamischen Parameter mit der Körperoberfläche entstehen kann.
- Formel Körperoberfläche
- KOF (m2) = Größe (cm) + Gewicht (kg) – (60/100)
Kalibrierung
Unkalibrierte Verfahren:
Bei der unkalibrierten Pulskonturanalyse wird das Herz-Zeit-Volumen (HMV) im Wesentlichen durch eine Berechnung aus der Pulskontur ermittelt, ohne dass eine initiale, externe Kalibrierung stattfinden muss. Hierbei bedienen sich die Geräte eines mathematischen Algorithmus, in den verschiedene Parameter wie zum Beispiel Alter, Geschlecht, Größe und Gewicht der Patient*innen eingehen.
Die Messung erfolgt über einen Sensor, der an das arterielle Drucksystem angeschlossen wird. In der Regel sind dafür normale arterielle Druckmessungen ausreichend.
Kalibrierte Verfahren:
Bei einer kalibrierten Messung erfolgt auch eine Pulskonturanalyse, die allerdings zusätzlich mit einer transpulmonalen Indikatorverdünnung („Dilution“) kombiniert wird. Oft wird dazu eine Thermodilution eingesetzt, die Temperaturunterschiede misst und dadurch eine genaue Berechnung des Herz-Zeit-Volumens erlaubt. Durch dieses Verfahren lassen sich ergänzend noch kardiale und intrathorakale Volumina und weitere hämodynamische Parameter sehr genau bestimmen.
Für die kalibrierte Messung ist eine zentrale arterielle Druckmessung und ein spezieller Katheter (z.B. PiCCO oder Pulmonalarterieller Katheter) notwendig.
Abkürzung- und Erläuterungsverzeichnis:
Im Folgenden versuche ich, Euch die Abkürzungen und Bezeichnungen verständlich in alphabetischer Sortierung aufzulisten und die wichtigsten Anmerkungen dazu zusammenzufassen, sodass sich diese Liste auch zum erneuten „Nachschauen“ verwenden lässt:
| Arterielle Elastanz (Eadyn) | – Spiegelt die Nachlast des Herzens wider. – Definiert als das Verhältnis zwischen dem endsystolischen Druck (ESP) des linken Ventrikels (LV) und dem Schlagvolumen (SV): Ea = ESP/ SV. – Normbereich: 1.10 – 1.40 mmHg/ml. |
| Cardiac power index (CPI) | – Laut Hersteller (PiCCO): Leistung des linksventrikulären Herzzeitvolumens in Watt. – Normbereich: 0,5 – 0,7 Watt/m². |
| dP/dt max | – Soll ein Maß für die Kontraktilität des linken Ventrikels ermittelt werden, kann man die Änderung der intraventrikulären Druckanstiegsgeschwindigkeit ΔP/Δt -> Änderung des Druckes gemessen auf die Zeit bestimmen. – Das Maximum dieses Wertes wird als hämodynamischer Parameter eingesetzt. – Normbereich: 0.9 – 1.3 mmHg/msec. |
| Downslope time (DSt) | – Stellt die Auswaschfunktion des Indikators dar. Ermittelt wird die Downslope time aus dem abfallenden Teil der Thermodilutionskurve (siehe Abbildung im Abschnitt PiCCO). |
| Extravasales Lungenwasser (EVLW) | – Beschreibt den Flüssigkeitsanteil der Lunge, der extrabasal gelegen ist. – Indizierter Wert auf KOF bezogen: ELWI. – Normwert ELWI 3 – 7 ml/kgKG.  |
| Gemischt-venöse Sauerstoffsättigung (SgvO2) | – Beschreibung: Über den distalen Schenkel des PAK kann Blut aus der A. pulmonalis entnommen werden, dieses Blut ist eine Mischung aus V. cava superior und inferior und wird deshalb als gemischt-venös bezeichnet. Bei schwer kranken Patient*innen können sich Veränderungen dieser Sauerstoffsättigung ergeben: – Bedeutung: Im Schock kann die Sauerstoffausschöpfung in der unteren Körperhälfte deutlich zunehmen und dadurch die Sauerstoffsättigung in der V. cava inferior deutlich abnehmen. Die Sauerstoffausschöpfung des Gehirns bleibt auch im Schock nahezu identisch, sodass ein Abfall der SgvO2 unter die zentralvenöse Sauerstoffsättigung (Sättigung in V. cava superior, = SzvO2) möglich ist. Bei einer Sepsis kann die SgvO2 durch die Eröffnung von arterio-venösen Shunts und der damit resultierenden Verminderung der Sauerstoffausschöpfung erhöht sein. Befindet sich ein*e Patient*in in einem Zustand der schweren Herzinsuffizienz, muss der Körper regulatorisch mehr Sauerstoff ausschöpfen und die SgvO2 sinkt ab. – Im Vergleich zur zentralvenösen SzvO2 ist die SgvO2 aussagekräftiger, da sie auch die untere Körperhälfte in die Berechnung mit einbezieht. – Normalwert circa 75%. |
| Globale Auswurffraktion (GEF) | – Laut Hersteller (PiCCO) der prozentuale Anteil des Volumens in einer Herzkammer, das bei einer einzelnen Kontraktion ausgeworfen wird. – Normbereich 25-35 %. |
| Globaler enddiastolischer Volumenindex (GEDI) | – Bezieht man das GEDV auf die Körperoberfläche, so ergibt sich das GEDI. – Normwerte sind hierbei 680-800 ml/m². |
| Globales enddiastolisches Volumen (GEDV) | – Summe aus den enddiastolischen Volumina des rechten und linken Ventrikels. – Gibt die Höhe des Vorlastvolumens an und stellt somit einen Vorlastparameter dar.  |
| Herzindex (HI, CI = Cardiac index) und Herz-Zeit-Volumen (HZV, Cardiac Output = CO) / Herz-Minuten-Volumen (HMV) | – Der Herzindex beschreibt das auf die Körperoberfläche bezogenes Thermodilutions-Herzzeitvolumen. – (HI = HZV/KOF) (Normalbereich zwischen 2,4 – 4 l/min/m2). – Normbereich Herzindex: 2.6 – 3.8 l/(min*m²) -> dies entspricht circa 60 % des Herz-Minuten-Volumens. -> Zur Bestimmung des Herz-Minuten-Volumens, worüber sich der HI bestimmen lässt, muss bei einem PAK (wie bei dem PiCCO Verfahren auch) ein vordefiniertes Volumen (meist 10-15 ml) an kalter NaCl-Lösung in den rechten Vorhof möglichst nahe der Trikuspidalklappe injiziert werden. Daraufhin erfolgt der Transport der Flüssigkeit über den rechten Ventrikel in die A. pulmonalis. Hier finden eine zusätzlich Verdünnung und die Erwärmung der NaCl-Lösung statt. Am PAK selbst erfolgt dann circa 4 cm vor der Spitze die Temperaturmessung des Blutes mittels eines Temperaturfühlers (Thermistor). Anhand der Temperaturänderung, die am Thermistor gemessen wurde, kann das Herz-Minuten-Volumen (HMV, Cardiac output = CO) aus der Fläche der Temperatur-Zeit-Kurve errechnet werden. Die Berechnung für das Herz-Minuten-Volumen mittels PiCCO erfolgt anhand der Fläche unter dem systolischen Teil der arteriellen Druckkurve, der Form der Druckkurve, der Herzfrequenz, einem Kalibrierungsfaktor und der Compliance der Aorta, welche wiederum mittels transpulmonaler Thermodilution eruiert werden kann. – Normbereich Herz-Minuten-Volumen: 4.0 – 8.0 l/min. |
| HPI – Hypotension prediction index | – Anhand eines Algorithmus wird berechnet, wie hoch die Wahrscheinlichkeit für das Auftreten einer Hypotension sein wird (Bereich von 0-100). Hierbei ist ein hypotensives Ereignis als ein MAP < 65 mmHg für die Dauer von mindestens einer Minute definiert. Umso höher die Zahl, desto eher kommt es im weiteren Verlauf ohne ein Gegensteuern zu einer Hypotension. – Der HPI-Parameterwert wird alle 20 Sekunden aktualisiert und liefert kontinuierliche prädiktive Ergebnisse. Die diagnostische Leistung des HPI-Parameters wurde mittels klinischer Validierungsstudien zuvor bewertet. |
| Intrathorakales Blutvolumen (ITBV) | – Beschreibt das intrathorakale Blutvolumen ohne das extravasale Lungenwasser. – Berechnung: Globales enddiastolisches Volumen (GEDV) + Blutvolumen der pulmonalen Strombahn; bzw. ITBV = GEDV x 1,25.  |
| Intrathorakales Thermovolumen (ITTV) | – Beschreibt das intrathorakale Blutvolumen insgesamt. – Berechnung: ITTV= HZV x MTt  |
| Kardialer Funktionsindex (CFI) | – Repräsentiert das Verhältnis zwischen Herzzeitvolumen und Vorlastvolumen und gibt laut Hersteller (PiCCO) Auskunft über die Herzleistung. – Normbereich 4,5-6,5 1/min. |
| Mean transit time (MTt) | – Mittlere Durchgangszeit: Die Zeit nach der die Hälfte des Indikators den Detektionsort (zentrale Arterie) passiert hat. Bestimmt wird sie durch die Halbierungslinie der Fläche unter der Thermodilutionskurve (siehe Abbildung im Abschnitt PiCCO). |
| Passive leg raise (PLR) | Reagibilität auf „Autotransfusion“, durch Veränderung der Lage und „Kippung“ des Bettes. |
| Pulmonal-arterieller Druck (Pulmonary artery pressure = PAP) | – Wird über den distalen Schenkel des PAK gemessen. – Unter normalen Bedingungen entspricht der diastolische Druck in der A. pulmonalis ungefähr dem pulmonalkapillären Verschlussdruck (PCWP, s.u.). – Der PAP kann zum Beispiel bei einer Lungenarterienembolie erhöht sein. – Normalbereich Druck in A. pulmonalis: Systolisch: 25 ± 7, diastolisch 9 ± 4, mittlerer Druck 15 ± 5. |
| Pulmonal-arterieller Verschlussdruck (PCWP) | – Entspricht einem Maß des linksventrikulären enddiastolischen Füllungsdruckes (LVEDP). – Durch den Frank-Starling-Mechanismus führt eine Erhöhung/Erniedrigung des enddiastolischen Volumens demnach zu einer Erhöhung/Erniedrigung des Schlagvolumens. -> Aus diesen Gründen wurde er früher oft als Parameter zur Steuerung der Volumenzufuhr propagiert, wobei man dies zunehmend (z. B. unter anderem aufgrund von möglichen Veränderungen der ventrikulären Compliance) einschränken muss. ! Auch hier sind eher die zeitabhängigen Änderungen der Werte zu betrachten, als Absolutwerte ! – Normalbereich 6-12 mmHg. |
| Pulmonaler Gefäßwiderstandsindex (PVRI = pulmonary vascular resistance index) | – Globales Maß für die Druck-Fluss-Beziehung im Lungenkreislauf, berechnet aus Druckunterschied zwischen Lungenarterie und linkem Vorhof = Differenz zwischen mittlerem pulmonal-arteriellem Druck (PAP) und Wedge-Druck (PVRI = (PAP – PAWP)/HI). – Die Berechnung erfolgt aus dem pulmonal-arteriellen Mitteldruck, dem Wedge-Druck und dem Herzindex. – Eine Erhöhung des PVRI findet sich z. B. bei einer Lungenarterienembolie. Mittels des PVRI kann z. B. auch eine Einschätzung der rechtsventrikulären Nachlast gegeben werden. – Normalbereich 140 – 270 dyn*s/cm5/m². |
| Pulmonalvaskulärer Permeabilitätsindex (PVPI) | – Erlaubt laut Hersteller (PiCCO) die Unterscheidung zwischen einem kardial-bedingten und einem permeabilitäts-bedingten Lungenödem. – Normwerte laut Hersteller (PiCCO): < 3 kardiogenes Ödem, ≥ 3 Permeabilitäts-Ödem. |
| Pulsdruck-Varianz (PPV) – Pulse pressure variation | – Gibt die Varianz der Pulsdruck-Kurve an. – Berechnung: PPV = (PPmax – PPmin) / PPmean – Normbereich ≤ 10-15 %. |
| Schlagvolumen (SV) | – Gibt das in der Systole vom linken Ventrikel ausgeworfene Blut an und ist abhängig von Geschlecht und Belastung. Das Schlagvolumen berechnet sich als Differenz zwischen linksventrikulärem enddiastolischen Volumen und linksventrikulärem Restvolumen. – Das Schlagvolumen kann bei Herzinsuffizienz, Herzmuskel- oder Herzklappenerkrankungen erniedrigt und bei einer Sympathikusaktivierung im Rahmen des Frank-Starling-Mechanismus erhöht sein. – Normbereich: 60 – 100 ml. |
| Schlagvolumenindex (SVI) | – Der Schlagvolumenindex ist ein Maß für die systolische Herzleistung während eines Herzzyklus. Bezeichnet man das Schlagvolumen als Schlagvolumenindex, wird zur Berechnung der Herzindex herangezogen. – Berechnung: SVI = Herzindex / Herzfrequenz. – Normalbereich 20 – 45 ml/m². |
| Systemischer Gefäßwiderstandsindex (SVRI = systemic vascular resistance index) | – Der SVRI beschreibt die Beziehung zwischen dem systemischen Druck und dem Blutfluss (= SVR). Indiziert auf die KOF ergibt sich daraus der SVRI. – Verwendung findet der SVRI bei der vereinfachten Bestimmung der Nachlast, da der SVRI als Maß dieser angesehen werden kann. (Die Nachlast entspricht der Muskelspannung des linken (bzw. rechten) Ventrikels, die während der Auswurfphase aufgebracht werden muss. Übersteigt die Nachlast die Leistung des Herzens kann eine kardiale Dekompensation die Folge sein). – Die Berechnung erfolgt aus arteriellem Mitteldruck, ZVD und Herzindex. –> Bei der Gabe von Vasodilatatoren oder bei Vorliegen einer Sepsis kann der SVRI abfallen, umgekehrt kann bei der Verwendung von vasokonstriktorischen Medikamenten (wie z.B. Katecholaminen) der SVRI ansteigen. – Normalbereich zwischen 1400 – 2500 dyn*s/cm(-5)/m² (entspricht: 80 (Korrekturfaktor) x mmHg/l/min/m² (Wood-Einheiten)). – (Kommt einem statt dem SVRI der TPR (total peripheral resistance) unter, wurde statt dem HI das Herz-Minuten-Volumen (CO) verwendet). |
| Systolic pressure variation (SPV) | – Beschreibt die Variation zwischen dem Minimum und Maximum des sytolischen Blutdrucks. |
| Schlagvolumen-Varianz (SVV) | – Gibt die Varianz des Schlagvolumens an. – Berechnung: SVV = SVmax – SVmin / SVmean – Normbereich ≤ 10-15 %. |
| Transpulmonale Thermodilution | – Volumentrische Vorlastparameter können mittels transpulmonaler Thermodilution gemessen werden. – Aus dem hieraus resultierenden HZV werden durch Multiplikation mit der mean transit time (MTt) und der Downslope time (DSt) der transpulmonalen Temperatur-Zeit-Kurve das intrathorakale Thermovolumen (ITTV) gemessen (ITTV= HZV x MTt). Des Weiteren kann auch das pulmonale Thermovolumen (PTV=HZV x DSt) berechnet werden. Subtrahiert man nun ITTV minus PTV, ergibt sich das globale enddiastolische Volumen (GEDV) (GEDV = ITTV – PTV). Das intrathorakale Blutvolumen wird aus dem GEDV anhand eines empirisch bestimmten Korrekturfaktors berechnet (ITBV=1,25 × GEDV). (aus S3 LL) |
| Varianz | Rechnerisch ermittelte Größe zur Charakterisierung der Streuung der Einzelwerte einer Messreihe um ihren Mittelwert (Streuungsmaß). (aus Pschyrembel) |
| ZVD – Zentraler Venendruck | – Die Messung erfolgt entweder über einen ZVK (zentraler Venenkatheter) oder mittels eines Druckaufnehmers am proximalen Ende des PAK. – (Normalbereich 0 – 5 mmHg). – Wichtiger als Absolutwerte zur Korrelation mit dem intravasalen Volumen sind die zeitabhängigen Änderungen des ZVD, die eher mit einer Änderung des Blutvolumens korrelieren können. – CAVE: Eine Perikardtamponade kann auch den ZVD erhöhen! (Teil der Beck-Trias bei Perikardtamponade: 1. arterielle Hypotension, 2. Erhöhung des ZVD (Halsvenenstauung), 3. abgeschwächte Herztöne bei kardialer Auskultation; weitere Leitsymptome Perikardtamponade: Dyspnoe, Tachykardie, Pulsus paradoxus, (Olig-/Anurie)). |
Nachdem ihr Euch nun durch den anstrengenden Teil dieses Artikels gearbeitet habt, kommen jetzt die hoffentlich etwas weniger trockenen Ausführungen zu den einzelnen Möglichkeiten. 😉
Nicht-invasive Möglichkeiten
„Passive leg raise“ Manöver – PLR
Der Test ist dazu gedacht, eine Information darüber zu erlangen, wie der Körper beziehungsweise z.B. das HZV der Patientin/des Patienten auf die Volumenexpansion von circa 300-450 ml venösen Blutes reagiert und ob eine Steigerung des HZV erreicht werden kann. Der PLR imitiert sozusagen eine „Volumenchallenge“.
Da aber kein Volumen zusätzlich verabreicht werden muss, werden die Risiken eines schädlichen Volumenüberschusses durch häufige Infusionsboli – und somit einer Volumenüberladung mit der Folge von Wundheilungsstörungen, intestinaler Paralysen, Lungenödem oder Perfusionsstörungen durch ein interstitielles Ödem – minimiert.
Hierbei sollen fünf Regeln beachtet werden:
- Startposition Oberkörper-Hochlage 45 °, um die Sensitivität des Testes zu erhöhen.
- Es folgt das passive Heben der Beine mittels Adjustierens des Bettes: Der Kopf bleibt hierbei gerade, die Beine werden um 45 ° erhöht. Dies soll am besten ohne ein Berühren des/der Patient*in erfolgen, damit keine Verzerrung der Ergebnisse durch Schmerz oder Erwachen entsteht.
- Nun erfolgt die Zeit-reale Messung des HZV, des Schlagvolumens oder weiterer Surrogat Parameter. Der Effekt muss in einem kurzen Zeitintervall (30-90 Sekunden) evaluiert werden, da die Effekte nach circa einer Minute verschwinden können.
- Wichtig ist zudem, dass das HZV sowohl vor, während als auch nach dem „Zurücklagern“ des Patienten/ der Patientin gemessen wird.
- Schmerzen, Husten, Unwohlsein und Aufwachen können Störfaktoren für eine adäquate Messung sein, weshalb ein PLR immer besser mittels einer „Kippung des Bettes“ durchgeführt werden soll.
Grundsätzlich gilt, dass ein Ansprechen auf einen Volumenbolus von 500 ml generell als Erhöhung des Schlagvolumens (SV) oder des HZV um 10-15 % zu bewerten ist. In einer Metaanalyse von Cavallaro et al. zeigte sich, dass das HZV einen höheren prädiktiven Vorhersagewert als die gemessene „Pulse pressure“ hat.
Sofern diese Regeln eingehalten werden, kann man den Volumenbedarf einer Patientin/eines Patienten relativ risikoarm – im Vergleich zu einer typischen Volumenchallenge – abschätzen: Denn wurde bei einer Volumenchallenge die Flüssigkeit der Patientin/dem Patienten appliziert, kann auch eine Volumenüberladung die Folge sein.

Natürlich sind auch beim PLR Risiken beziehungsweise Kontraindikationen zu beachten: So heißt es in der S3-Leitlinie „Intravasale Volumentherapie bei Erwachsenen“, dass instabile Beckenfrakturen, ausgeprägte intraabdominelle Hypertension oder auch ein erhöhter Hirndruck Kontraindikationen darstellen. Ein weiteres Problem kann schon die standardisierte Durchführung sein, etwa wenn eine Oberschenkelamputation vorliegt oder ein kardiales Rückwärtsversagen vorhanden ist. Beatmung oder Arrhythmien hingegen sollen laut S3-Leitlinie keinen relevanten Einfluss auf die Ergebnisse haben.
Natürlich ist diese Möglichkeit der Evaluation eher den Patient*innen auf der Intensivstation vorbehalten, da die Patient*innen im OP oft nicht einfach so „hin und her“ gekippt werden können, sobald die Operation begonnen hat – nicht wahr liebe Chirurg*innen?
„Volumechallenge“ oder Volumentest
Hierbei wird in der Regel über einen fest definierten Zeitraum (oft 5-10 Minuten) ein bestimmter Volumenbolus infundiert (in der Regel 50-250 ml oder 3 ml/kgKG), um herauszufinden, ob eine Volumenreagibilität besteht. Gleichzeitig wird aber durch die eher geringere Menge eine zu liberale Flüssigkeitsgabe vermeiden. Eine positive Reaktion in Bezug auf das SV, gemessen mittels eines HZV-Monitors, wurde als positiv angesehen, wenn das SV um 10-15 % anstieg (Cecconi et al.).
Laut Studienlage reagieren nur circa 50 % der kritisch kranken Patient*innen positiv auf eine Volumenchallenge, weshalb oft auch mehrere Parameter hinzugezogen werden, um das richtige Maß der Volumengabe abschätzen zu können.
In der folgenden Tabelle, entnommen aus „What is a fluid challenge?“ von Cecconi et al., sind einzelne Prädiktoren aufgeführt.
| Parameter | Indikator | Prädiktor | Ziel der Therapie | Sicherheitslimit |
| Klinische Bewertung | Ja | Ja | Ja | Ja |
| Notwendigkeit der Katecholamintherapie | Ja | Nein | Ja | Nein |
| Herzfrequenz > 100 bpm | Ja | Nein | Ja | Nein |
| Cardiac Index < 2,5 l/min/m2 | Ja | Nein | Ja | Nein |
| Serum Laktat | Ja | Nein | Ja | Nein |
| SVV (Schlagvolumen Varianz) ≥ 10 % | Ja | Ja | Ja | Ja |
| SPV (Systolic pressure variability) > 10 % | Ja | Ja | Ja | Ja |
| PPV (Pulse pressure variability) | Ja | Ja | Ja | Ja |
| Reagibilität auf PLR | Ja | Ja | Nein | Nein |
-> Das „Ziel der Therapie“ meint immer eine Erhöhung des Schlagvolumens.
-> Die Bezeichnung „Sicherheitslimit“ bedeutet, dass man erkennen kann, dass der Volumenbolus nicht zum gewünschten Effekt (einer Erhöhung des Schlagvolumens) führt und deshalb kein erneuter Volumenbolus verabreicht werden sollte.
Laut S3-Leitlinie sollte die Volumenchallenge bei fehlender Veränderung der Surrogatparameter ein einmaliger Versuch bleiben.
Echokardiografie und weitere Ultraschalluntersuchungen:
Echokardiografie:
Da die Echokardiografie ein Thema für sich darstellt, sei in diesem Rahmen nur kurz auf die Echokardiografie im Rahmen der Erhebung eines Volumenstatus eingegangen:
Die Echokardiografie dient zur Beurteilung der kardialen Leistungsfähigkeit und der Kreislaufparameter. Für die Umsetzung sind spezielle Qualifikationen notwendig.
Die Indikationen zur Beurteilung des Volumenstatus sind die hämodynamische Instabilität (TTE) und spezielle Fragestellungen wie intrakardiale Thromben und Raumforderungen (TEE). Mittels Echokardiografie ist es möglich, die systolische und diastolische Pumpfunktion beider Ventrikel zu bestimmen, einen Anhaltspunkt für das Maß der Vorlast mittels des enddiastolischen Volumens zu erlangen, Herzklappenvitien zu eruieren sowie eine Veränderung des Perikards (z. B. eine Tamponade) zu beurteilen. Auch gibt die Echokardiografie Anhaltspunkte für die aktuelle Füllung des Herzens (Stichwort „kissing ventricles“) und ob regionale Wandbewegungsstörungen bestehen.
Ultraschall der Vena cava inferior:
Eine weitere Möglichkeit, den Volumenstatus der Patient*innen zu eruieren, ist die sonografische Untersuchung der Vena cava inferior u. a. in der longitudinalen Achse (paramedianer Längsschnitt rechts):
- Zunächst Darstellung der V. cava transversal in kurzer Achse, dann Rotation des Schallkopfes im Uhrzeigersinn um 90 °.
- Merke: Die Kollapsneigung im respiratorischen Zyklus ist typisch.
- Der Messpunkt befindet sich 2 cm unterhalb des Zwerchfells.
- Durchmesser:
- < 1 cm mit Kollapsneigung: geringe Volumenfüllung.
- > 2 cm ohne Kollapsneigung: gute Volumenfüllung.
- Bei jungen sportlichen Menschen kann eine Größe von > 2,5 cm durchaus physiologisch sein.
- Bei > 2,5 cm ohne respiratorische Variabilität und zusätzlich gestauten Halsvenen kann man von einem rechtsatrialen Druck von circa 20 mmHg ausgehen.
Invasive Möglichkeiten
Analyse der arteriellen Kurvenform (PPV, SVV, (SPV))
Während einer Operation, wie oben beschrieben, ist eine invasive arterielle Blutdruckmessung oft ein Standard-Vorgehen.
Hierbei ist auf eine „gute Qualität“ der arteriellen Kurve zu achten. So kann die Kurve zum Beispiel unterdämpft oder überdämpft sein:

In den letzten Jahren haben sich verschiedene dynamische Parameter herauskristallisiert, welche oft auf den Veränderungen der Pulskurve beruhen: „Pulse Pressure Variation“ (Pulsdruck-Variation) und „Systolic Pressure Variation“ (SPV) entstammen der Analyse der arteriellen Kurvenform, die Schlagvolumen-Variation (SVV) der Pulskonturanalyse.
Die Berechnung von SVV lautet SVV = (SVmax – SVmin) / SVmean. Die Berechnung des PPV lautet PPV = (PPmax – PPmin) / PPmean.
Befinden sich die Schlagvolumen-Variation < 10 %, so ist die Volumenreagibilität des Patienten/der Patientin gering. Allerdings gilt dies nur, wenn folgende Voraussetzungen erfüllt sind:
- Invasive und voll kontrollierte Beatmung mit einem Tidalvolumen von 8 ml/kg ideales KG
- Sinusrhythmus
- Pulskurve ohne Artefakte

Hintergrund:
Die SVV ergibt sich aus der Varianz des Schlagvolumens während der Inspiration und der Exspiration, bei der durch die Inspiration zunächst der Rückstrom zum rechten Herzen vermindert und die Nachlast des rechten Ventrikels erhöht wird. Daraufhin kommt es im weiteren Verlauf zu einem Abfall des linksventrikulären Schlagvolumens (über die linksventrikuläre Vorlastsenkung). Umso größer diese Schwankung, umso eher liegt ein Volumenbedarf vor. (Laut Leitlinie „Empfehlungen zum hämodynamischen Monitoring in der internistischen Intensivmedizin“ stellt eine SVV von 9,5 % einen Anstieg des Schlagvolumens um 5 % nach einer Flüssigkeitsinfusion von 100 ml dar (Sensitivität 79 %, Spezifität 93 %)). Dieser Mechanismus bestimmt auch die Messung des PPV.
Die systolische Blutdruck Variation (SPV) und die Pulsdruck-Variation (PPV) stellen weitere Parameter dar, mithilfe derer man die Volumenreagibilität bemessen kann, wobei die Grenze des SPV auch bei < 10% und die Grenze des PPV bei < 13 % liegt.
MostCare (nicht-kalibriert)
Das hämodynamische Monitoring mittels most-care up ® von Vygon stellt eine Variante dar, die auf einer Berechnung der hämodynamischen Parameter anhand der arteriellen Druckkurve beruht. Dieser patentierte Algorithmus (uncalibrated Pressure Recording Analytical Method – uPRAM) analysiert und berechnet anhand der charakteristischen Kurve und eines individuellen Kalibrationsfaktors – der das Alter, die Körperoberfläche (KOF) und das Geschlecht einbezieht – und Parameter der Vorlast, Kontraktilität und der Nachlast Herzschlag um Herzschlag liefert.
Es ist ein „Plug and Play“ Verfahren, für das eine Kalibrierung (wie z. B. bei einer PiCCO) oder ein spezieller Katheter nicht notwendig ist.
Welche wichtigen hämodynamischen Parameter werden berechnet?
Ausführliche Erläuterungen zu den einzelnen Parametern siehe oben in der Tabelle 1.
- Schlagvolumen (SV)
- Normbereich: 60 – 100 ml
- Schlagvolumenindex
- Normbereich: 35 – 45 ml/m²
- Herz-Minuten-Volumen (HMV)
- Normbereich 4.0 – 8.0 l/min
- Herzindex (Cardiac index)
- Normbereich: 2.6 – 3.8 l/(min*m²)
- Dynamische Variablen:
- SVV
- Schlagvolumen-Varianz
- Normbereich MostCare: < 15 %
- Schlagvolumen-Varianz
- PPV
- Pulsdruck-Variation
- Normbereich MostCare: < 15 %
- Pulsdruck-Variation
- SPV
- Systolische Druckvariation
- SVV
- dP/dt max
- Maximaler linksventrikulärer Druckanstieg.
- Jetzt wird es vorklinisch:
- Wir erinnern uns an die Diagramme des Herzzyklus und das dortige Druck-Zeit-Diagramm:

- Möchte man nun ein Maß für die Kontraktilität des linken Ventrikels ermitteln, kann man die Änderung der intraventrikulären Druckanstiegsgeschwindigkeit ΔP/Δt -> Änderung des Druckes gemessen auf die Zeit bestimmen.
- Das Maximum dieses Wertes wird als hämodynamischer Parameter eingesetzt.
- Normbereich: 0.9 – 1.3 mmHg/msec
- Wir erinnern uns an die Diagramme des Herzzyklus und das dortige Druck-Zeit-Diagramm:
- Abgeleitete Variablen:
- Systemischer Gefäßwiderstandsindex (SVRI = systemic vascular resistance index)
- Beziehung zwischen dem systemischen Druck und dem Blutfluss (= SVR), indiziert auf die KOF, ergibt sich daraus der SVRI.
- Normalbereich zwischen 1400 – 2500 dyn*s/cm5/m² (entspricht: mmHg/l/min/m² = Wood-Einheiten).
- Systemischer Gefäßwiderstandsindex (SVRI = systemic vascular resistance index)
- Arterielle Elastanz (Eadyn)
- Spiegelt die Nachlast des Herzens wider.
- Normbereich: 1.10 – 1.40 mmHg/ml
Edwards Monitore inklusive Acumen IQ Sensor ® (nicht kalibriert)
Ausführliche Erläuterungen zu den einzelnen Parametern siehe oben in der Tabelle 1.
- Berechnete Parameter
- Hypotension Prediction Index
- Zahlenwerte zwischen 0 und 100, umso höher die Zahl umso eher kommt es zu einer Hypotension im kurzfristigen Verlauf.
- Herz-Minuten-Volumen (HMV)
- Systemischer vaskulärer Widerstand
- Pulsfrequenz (Pulse rate = PR)
- Schlagvolumen (SV)
- Schlagvolumen-Varianz (SVV)
- dynamischer arterieller Elastizität (Eadyn)
- Hypotension Prediction Index
PiCCO – Pulse index Continuous Cardiac Output
1997 wurde mit PiCCO im Vergleich zum Pulmonalarteriellen Katheter (s. u.) ein deutlich weniger invasives Verfahren eingeführt, um hämodynamische Parameter (unter anderem das HMV) und volumetrische Parameter (wie das extravasale Lungenwasser (EVLW)) messen zu können. Einsetzbar ist das Verfahren, wenn ein ZVK einliegt und eine arterielle Druckmessung mittels eines PiCCO-Katheters erfolgt. Die Besonderheit des PiCCO-Katheters, der in der A. femoralis oder A. brachialis platziert werden muss, ist die Temperatursonde. Über den einliegenden PiCCO-Katheter kann auch der arterielle Blutdruck normal gemessen werden.
Das Verfahren verwendet eine kontinuierliche Pulskonturanalyse, welche mittels regelmäßiger transpulmonaler Thermodilution kalibriert wird. Hierdurch ergeben sich weitere Messwerte als bei einer alleinigen Pulskonturanalyse (z.B. MostCare). Mögliche Indikationen stellen eine schwere Herzinsuffizienz, ein Schock, das ARDS, ein Polytrauma oder Verbrennungen bei Patient*innen dar. Des Weiteren ist ein hämodynamisches Monitoring z.B. mittels PiCCO bei einer Mesenterialischämie empfohlen.
Kontinuierliche Pulskonturanalyse der arteriellen Druckkurve:
Ausführliche Erläuterungen zu den einzelnen Parametern siehe oben in der Tabelle 1.
- Folgende Parameter können ermittelt werden:
- Herz-Minuten-Volumen (HMV)
- Schlagvolumenindex (SVI) – Maß für die systolische Herzleistung während eines Herzzyklus.
- (SVI = HI/HF; Normalbereich 20 – 40 ml/m²).
- Systemischer Gefäßwiderstandsindex (SVRI = systemic vascular resistance index)
- Beziehung zwischen dem systemischen Druck und dem Blutfluss (= SVR), indiziert auf die KOF ergibt sich daraus der SVRI.
- Normalbereich zwischen 1400 – 2500 dyn*s/cm5/m² (entspricht: mmHg/l/min/m² = Wood-Einheiten).
- Intrathorakales Blutvolumen (ITBV)
- Extravasales Lungenwasser (EVLW)

- Indizierter Wert auf KOF bezogen: ELWI.
- Normwert 3 – 7 ml/kgKG.
- Für die Berechnung notwendige Begriffe: Mean Transit time ↓

- Roter Pfeil = Injektion der kalten Infusionslösung (idR 10-15 ml).
- MTt = Mittlere Durchgangszeit
- DSt = „Downslope time“
- Globales enddiastolisches Volumen (GEDV) – Summe aus den enddiastolischen Volumina des rechten und linken Ventrikels
- Gibt die Höhe des Vorlastvolumens an und stellt somit einen Vorlastparameter dar.
- Globaler enddiastolischer Volumenindex (GEDI)
- Bezieht man das GEDV auf die Körperoberfläche, so ergibt sich das GEDI.
- Normwerte sind hierbei 680-800 ml/m².
- Weitere Werte (der Vollständigkeit halber aufgelistet, klinisch aber weniger relevant):
- Pulmonalvaskulärer Permeabilitätsindex (PVPI)
- Globale Auswurffraktion (GEF)
- Kardialer Funktionsindex (CFI)
- Cardiac power index (CPI)
Zu beachten ist, dass es sich um abgeleitete Größen handelt, die im Falle einer maschinellen Beatmung validiert sind. Einschränkungen, wie ein Rechtsherzversagen, höhergradige Insuffizienzen der Herzklappen und Herzrhythmusstörungen, führen zu eingeschränkt verwertbaren Messwerten. Es gilt auch hier die Zusammenschau der Befunde zu beurteilen und keine einzelnen Parameter, sondern immer – wie immer – den „ganzen“ Patienten / die „ganze“ Patientin zu behandeln.
PiCCO und extracorporale Membranoxygenierung (ECMO)
Zu diesem Thema gibt es leider äußerst wenig Evidenz. Es scheint aber nachvollziehbar, dass unter laufender ECMO-Therapie mit externer Heizung die Thermodilution beeinflusst werden kann. Im November 2019 untersuchten die Kollegen um Herner et al. diesen Mangel an Daten und analysierten die Parameter vor und während einer ECMO-Therapie:
Die Studie zeigte einen deutlichen Anstieg von GEDVI und EVLWI nach Beginn der ECMO-Therapie.
Hierbei waren die Anstiege bei femoraler Injektion des Indikators für die Thermodilution stärker ausgeprägt als bei jugulärer. Diese Ergebnisse stehen im Einklang mit der Hypothese, dass ein Verlust von Indikator in den extrakorporalen Kreislauf während der ECMO-Therapie stattfindet.
Im Gegensatz dazu wurden der Herzindex und hämodynamische Parameter, die nicht von der Thermodilution abgeleitet wurden, durch den extrakorporalen Kreislauf nicht wesentlich beeinflusst. (Herner et al.)
Auch eine Arbeit aus dem Jahr 2021 von Loosen et al. zog einen Vergleich des Schlagvolumens unter laufender ECMO-Therapie. Hierbei erfolgte eine Messung des Schlagvolumens einerseits mittels PiCCO und andererseits mittels Echokardiografie. Es zeigte sich auch in dieser Arbeit eine Veränderung des EVLWI, sodass vor allem dieser Parameter als nicht valide angesehen werden kann.
PiCCO und CVVH mit hohem Blutfluss
Mehrere Arbeitsgruppen beschäftigten sich mit dem Thema, ob durch eine kontinuierliche veno-venöse Hämofiltration (CVVH) mit hohem Blutpumpenfluss die Messungen des Herzindex, des GEDVI und des EVLWI mittels transpulmonaler Thermodilution, verändert werden. Hierbei stellten mehrere Autor*innen fest, dass keine Beeinflussung durch eine CVVH stattfindet (z.B. Dufour et al.).
Lithium dilutions cardiac output
Ähnlich zur PiCCO, Berechnung allerdings mittels Lithiumchlorid-Bolus, welcher zentral appliziert, dann wie bei PiCCO / PAK auch durch das restliche Blut verdünnt und im Verlauf an einem peripheren arteriellen Zugang gemessen wird. Darüber ist eine Berechnung des HMV möglich.
PAK – Pulmonalarterienkatheter (früher Swan-Ganz-Katheter oder Einschwemmkatheter)
Der PAK ist ein Katheter, der sich zur Messung des Herz-Minuten-Volumens, einer Messung des Drucks in der Pulmonalarterie und zur Messung des ZVDs eignet. Dies kann sich im Hinblick auf eine differenzierte Katecholamin-, Vasodilatanzien- und Volumentherapie sinnvoll darstellen.
Das klinische Vorgehen ist Folgendes: Der Katheter wird über das venöse System durch das rechte Herz weiter in die A. pulmonalis eingeführt. Da dieses Verfahren eine hohe Invasivität besitzt, wird die Anlage eines PAKs sehr kontrovers diskutiert:
Im Januar 2021 erschien ein Review Artikel von Navas-Blanco et al. im Journal „Annals of Cardiac Anaesthesia“, der diese Diskussion erneut aufgriff und die einzelnen Aspekte zusammenfasste. Die Autoren sind der Überzeugung, dass der PAK zwar eine valide Technik sei, um bestimmte Messwerte zu erlangen, die Technik aber keinen Effekt auf Mortalität und Morbidität habe und zudem eine größere Gefahr von Komplikationen, wie einer Gefäßruptur, zur Folge haben könne.
In einem Editorial von Sarkar et al. (erschienen im selbigen Journal im Januar 2021) war die Aussage der Autoren, der PAK habe weiterhin einen Platz in der Diagnostik von Hoch-Risiko-Situationen, die Indikation sollte aber aufgrund des Risikoprofils sehr eng gestellt werden.
Da ein sehr ausgewähltes Patientenklientel aber dennoch von einer genauen Messung mittels PAK profitieren kann, möchten wir hier die wichtigsten Punkte bezüglich des PAK zusammenfassen:
- Mögliche Indikationen
- Sehr streng zu stellen.
- Kardiochirurgisches Pantientenklientel.
- Hoch-Risiko-Situationen und nach individuellem Ermessen und Können des behandelnden intensivmedizinischen Teams bzw. der Intensivmediziner*innen.
- Kontraindikationen:
- Absolut:
- Trikuspidal- oder Pulmonalklappen-stenose /-ersatz
- Thrombus oder Tumor im rechten Herzen
- Rechtsherzendokarditis
- Relativ:
- Schwere vorbestehende Herzrhythmusstörungen
- Schwere Gerinnungsstörungen
- Neu gelegte Schrittmacherelektrode (Gefahr der Dislokation)
- Absolut:
- Vorgehen der Katheterisierung:
- Zunächst Legen einer venösen Schleuse in die V. jugularis interna oder V. subclavia und (je nach Vorgaben des Herstellers) Kontrolle auf Dichtigkeit des Ballons. (Das distale Lumen des Katheters ist mit einem Druckwandler verbunden, mit dessen Hilfe die Gefäßdrücke beim Vorschieben des Katheters überwacht werden).
- Vorschieben des Katheters:
- Schraubverschluss hinten am Katheterende öffnen und Katheter vorschieben und Veränderungen der Druckkurven beachten:
- Druckkurve in V. cava superior:
- Sobald eine venöse Druckkurve aufgezeichnet wird, soll der Ballon mit 1,5 ml Luft gefüllt werden, daraufhin schiebt man den Katheter weiter vor.
- Die Druckkurve des rechten Vorhofs entspricht der Druckkurve der V. cava superior

- Druckkurve in V. cava superior:
- Druckkurve in rechtem Ventrikel: pulsatil
- Nach der Passage der Pulmonalklappe zeigt sich ein Anstieg des diastolischen Drucks (bedingt durch den Gefäßwiderstand im Lungenkreislauf), während der systolische Druck unverändert bleibt.
- Beim Vorschieben des Katheters in die Pulmonalarterie verschwindet die pulsatile Form der Druckkurve. Es bleibt der pulmonal-arterielle Verschlussdruck (auch Wedge-Druck oder PCWP = pulmonary-capillary wedge pressure oder PAWP (pulmonary artery wedge pressure) genannt) zurück und spiegelt den Füllungsdruck im linken Herzen wider. (Wedge-Position idR nach circa 50 cm).
- Schraubverschluss hinten am Katheterende öffnen und Katheter vorschieben und Veränderungen der Druckkurven beachten:
- Der Katheter sollte niemals tiefer als 60 cm eingeführt werden.
- Sobald die typische Wedge-Druck-Kurve erscheint, wird der Katheter NICHT weiter vorgeschoben, sondern der Schraubverschluss verschlossen und der Ballon so schnell als möglich wieder entblockt.
- Sobald die typische Wedge-Druck-Kurve erscheint, wird der Katheter NICHT weiter vorgeschoben, sondern der Schraubverschluss verschlossen und der Ballon so schnell als möglich wieder entblockt.
- Generelle Anmerkungen: Der Katheter befindet sich in einer Hülle, sodass zu jeder Zeit die Sterilität gesichert ist. Für etwaige Lageveränderungen des Katheters ist es deshalb wichtig, diese Hülle nicht an Patienten (zum Beispiel durch ein Pflaster) zu befestigen. Des Weiteren ist das Vorhalten einer sterilen 2ml-Spritze zum Entblocken am Bett der Patientin/des Patienten sinnvoll.
Relevante Mess- und ableitbare hämodynamische Parameter:
Ausführliche Erläuterungen zu den einzelnen Parametern siehe oben in der Tabelle 1.
- Kardiovaskuläre Parameter – bezogen auf Erwachsene
- ZVD
- Messung mittels Druckaufnehmer am proximalen Ende des PAK
- Normalbereich 0 – 5 mmHg -> Zeitliche Änderung der Werte beachten, nicht Absolutwerte.
- Pulmonal-arterieller Druck (Pulmonary artery pressure = PAP)
- Wird über den distalen Schenkel des PAK gemessen.
- Normalbereich Druck in A. pulmonalis: Systolisch: 25 ± 7, diastolisch 9 ± 4, mittlerer Druck 15 ± 5
- Pulmonal-arterieller Verschlussdruck (PCWP)
- entspricht einem Maß des linksventrikulären enddiastolischen Füllungsdruckes (LVEDP)
- Normalbereich 6-12 mmHg
- Erinnerung: Kurve der Wedge-Position:

- Katheter NIEMALS längere Zeit so belassen! -> Gefahr der iatrogen-bedingten Embolie!
- Herzindex (HI, CI = Cardiac index)
- Schlagvolumenindex (SVI)
- Systemischer Gefäßwiderstandsindex (SVRI = systemic vascular resistance index)
- Pulmonaler Gefäßwiderstandsindex (PVRI = pulmonary vascular resistance index)
- Globales Maß für die Druck-Fluss-Beziehung im Lungenkreislauf, berechnet aus Druckunterschied zwischen Lungenarterie und linkem Vorhof = Differenz zwischen mittlerem pulmonal-arteriellem Druck (PAP) und Wedge-Druck
- Normalbereich 140 – 270 dyn*s/cm5/m²
- ZVD
- Gemischt-venöse Sauerstoffsättigung (SgvO2)
- Über den distalen Schenkel des PAK kann Blut aus der A. pulmonalis entnommen werden, dieses Blut ist eine Mischung aus V. cava superior und inferior und wird deshalb als gemischt-venös bezeichnet.
- Normalwert circa 75 %.
- Bei schwer kranken Patient*innen können sich Veränderungen dieser Sauerstoffsättigung ergeben:
- Im Schock kann die Sauerstoffausschöpfung in der unteren Körperhälfte deutlich zunehmen und dadurch die Sauerstoffsättigung in der V. cava inferior deutlich abnehmen. Die Sauerstoffausschöpfung des Gehirns bleibt auch im Schock nahezu identisch, sodass die SgvO2 unter die zentralvenöse Sauerstoffsättigung (Sättigung in V. cava superior, = SzvO2) abfallen kann.
- Bei einer Sepsis kann die SgvO2 durch die Eröffnung von arterio-venösen Shunts und der damit resultierenden Verminderung der Sauerstoffausschöpfung erhöht sein.
- Befindet sich ein Patient in einem Zustand der schweren Herzinsuffizienz, muss der Körper regulatorisch mehr Sauerstoff ausschöpfen und die SgvO2 sinkt ab.
- Im Vergleich zur zentralvenösen SzvO2 ist die SgvO2 aussagekräftiger, da sie auch die untere Körperhälfte in die Berechnung mit einbezieht.
- Beurteilung der Hämodynamik anhand der gemessenen Werte:
| Parameter | Rechtsherzinsuffizienz | Linksherzinsuffizienz | Volumenmangel | Septischer Schock |
| HMV | ↓ | ↓ | ↓ | ↑ |
| MAP | ↓ | ↓ | ↓ | ↓ |
| PCWP | ± | ↑ | ↓ | ↓ |
| Schlagvolumen | ↓ | ↓ | ↓ | ↑ |
| SVR | ↑ | ↑ | ↑ | ↓ |
| ZVD | ↑ | ↑/± | ↓ | ↓ |
HMV = Herz-Minuten-Volumen, MAP = mittlerer arterieller Druck, PCWP = pulmonale-arterieller Verschlussdruck, SVR = systemischer Gefäßwiderstand, ZVD = Zentraler Venendruck,; Tabelle: Beurteilung der Parameter bezogen auf unterschiedliche Krankheitsbilder.
- Gefahren / Komplikationen
- Herzrhythmusstörungen
- Mechanische Komplikationen (Ruptur Pulmonalarterienast; Verletzung der Herzklappen; Verknotung des Katheters)
- Gefäßkomplikationen (Lungeninfarkt bei versehentlichem Belassen in Wedge-Position; Thrombophlebitis, venöse Thrombosen, arterielle Fehlpunktion, Pneumothorax, Luftembolie)
- Infektion (Wechsel spätestens nach 7 Tagen, bzw. Belassen des Katheters für nur wenige Tage)
Der PAK wird inzwischen häufig durch das deutlich weniger invasive PiCCO-Monitoring ersetzt.
Was sich aus diesen Werten ableiten lässt, ist insgesamt sehr individuell und selbstredend müssen die hausinternen SOPs und Vorgaben beachtet werden. Dennoch kann der folgende Algorithmus aus der „SOP hämodynamisches Monitoring“ von den Kollegen Ellger et al. welcher aus einem Paper der Crit Care Med abgeleitet wurde, einige Hinweise geben:

Allgemeines:
In einem Review von Litton et al. wurden noch weitere Methoden zur Volumenbestimmung vorgestellt, welche aber in Deutschland insgesamt eher wenig verbreitet sind.
Punchlines:
Welche Mittel können unter anderem zur Verfügung stehen, um den Volumenbedarf eines Patienten / einer Patientin zu überprüfen?
- Indizierte Werte verbessern die Vergleichbarkeit.
- Kalibrierte Werte werden mittels einer Kombination aus Pulskonturanalyse und Verdünnung („Dilution“) des Blutes bestimmt.
- PLR
- 45 Grad
- Bett bewegen und nicht den Patienten/ die Patientin.
- Kontinuierliches hämodynamisches Monitoring ist obligat.
- Volumenchallenge
- Hämodynamisches Monitoring beachten.
- Bei fehlender Resonanz: Kein weiterer Versuch!
- Ultraschall
- Echokardiografie (TTE/TEE)
- Schall der V. cava
- SVV/PPV
- Nur bei Sinusrhythmus und invasiver Beatmung!
- Nicht-kalibrierte Verfahren wie z. B. MostCare oder Edwards-Monitor
- Bestimmung von
- HMV
- SVV/PPV
- dP/dt
- (SVRI)
- (Ea)
- (HPI)
- Bestimmung von
- PiCCO
- Weniger invasiv im Vergleich zu PAK.
- Zentrale Arterie und eigener Katheter notwendig.
- Zusätzlich zu den oben genannten:
- SVRI
- EVLW
- GEDI
- Pulmonal-Arterien-Katheter (PAK)
- Strenge Indikation
- Zusätzlich zu den oben genannten:
- PAP
- PCWP
- SgvO2
Wie immer sind alle gemessenen Werte – unabhängig vom Verfahren – ausschließlich in Zusammenschau mit der Klinik der Patient*innen, Laborwerten (wie z.B. Laktat oder ein Hb-Anstieg intraoperativ) und dem zeitlichen Verlauf bzw. der Dynamik im OP oder auf der Intensivstation (Blutung aus Drainagen, Tamponade) zu sehen!
Mögliche klinische Umsetzung:
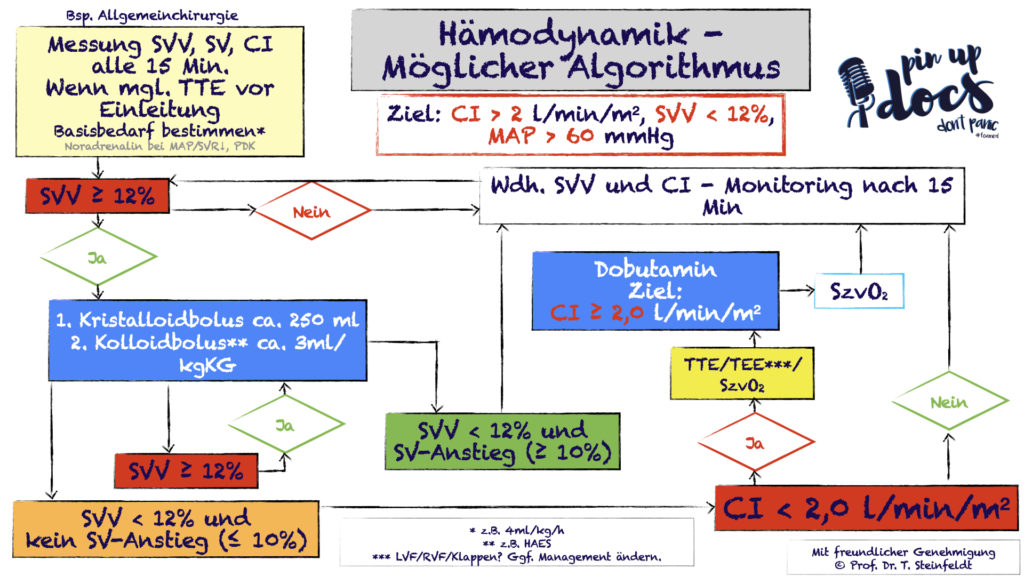
Abkürzungen s.o. , abgeleitet aus doi:10.1186/cc9070

Autorin:
Dr. med. Dana Maresa Spies – Assistenzärztin für Anästhesie und Intensivmedizin
Ich bedanke mich – wie immer – ganz herzlich bei dem Team der Pin-up-docs! Zusätzlich möchte ich meinen Dank aussprechen an Dr. Christine Gaik, Ruzica Axt, Julia Hoeft, Silke Scholz und an viele mehr, die mir Tipps gegeben, meine vielen Entwürfe gegengelesen und verbessert haben! Ihr seid toll!
Hinweis: Aus Gründen der Geschlechtsneutralität wird im Text gelegentlich der Asterisk (*) verwendet ;).
Quellen:
Kalibrierung
- S3-Leitlinie zur intensivmedizinischen Versorgung herzchirurgischer Patienten – Hämodynamisches Monitoring und Herz-Kreislauf
Passive leg raise
- Monnet X, Teboul JL. Passive leg raising: five rules, not a drop of fluid!. Crit Care. 2015;19(1):18. Published 2015 Jan 14. doi:10.1186/s13054-014-0708-5
- Pickett JD, Bridges E, Kritek PA, Whitney JD. Passive Leg-Raising and Prediction of Fluid Responsiveness: Systematic Review. Crit Care Nurse. 2017 Apr;37(2):32-47. doi: 10.4037/ccn2017205. PMID: 28365648.
- Lakhal K, Ehrmann S, Benzekri-Lefevre D, et al. Brachial cuff measurements of blood pressure during passive leg raising for fluid responsiveness prediction. Ann Fr Anest Reanim. 2012;31(5):67-72.
- Lakhal K, Ehrmann S, Runge I, et al. Central venous pressure measurements improve the accuracy of leg raising-induced change in pulse pressure to predict fluid responsiveness. Intensive Care Med. 2010;36(6):940-948.
- Garcia X, Pinsky M. Clinical applicability of functional hemodynamic monitoring. Ann Intensive Care. 2011;35(1):1-4.
- S3- Leitlinie: https://www.awmf.org/uploads/tx_szleitlinien/001-020l_S3_Intravasale-Volumentherapie-Erwachsene_2020-10.pdf
- A und I https://www.ai-online.info/images/ai-ausgabe/2019/05-2019/2019_5_255-264_Perioperative%20%20Ueberwachung%20des%20%20Volumenstatus.pdf
- Intensive Care Med (2010) 36:1475–1483 DOI 10.1007/s00134-010-1929-y (Cavallaro et al.) “Diagnostic accuracy of passive leg raising for prediction of fluid responsiveness in adults: systematic review and meta-analysis of clinical studies ”
Volumenchallenge
- S3- Leitlinie: https://www.awmf.org/uploads/tx_szleitlinien/001-020l_S3_Intravasale-Volumentherapie-Erwachsene_2020-10.pdf
- Cecconi M, Parsons AK, Rhodes A. What is a fluid challenge? Curr Opin Crit Care. 2011 Jun;17(3):290-5. doi: 10.1097/MCC.0b013e32834699cd. PMID: 21508838.
Echokardiografie und weitere Ultraschalluntersuchungen
- https://next.amboss.com/de/article/fM0kLg#Zdcd855cc341b397b9cb80abc02400d0e
- Die Anästhesie – Hans-Walter Striebel 3. Auflage – ISBN 978-3-7945-2942-1; Kapitel 21
- AEN – Ultraschall in der Intensiv- und Notfallmedizin; Grundlagen Nadelnavigation, Gefäße, Echokardiografie, Atemnotdiagnostik, FAST, Abdomen, Nervus opticus; ISBN: 978-3-9819-7270-2
Analyse der arteriellen Kurvenform (PPV, SVV, (SPV))
- https://www.getinge.com/siteassets/products-a-z/picco/de/picco-technology-brochure-de_r07-screen.pdf
- https://leitlinien.dgk.org/files/2016_Empfehlung_Hämodynamisches_Monitoring_Neu.pdf
MostCare
- https://www.vygon.de/index.php/fuseaction/download/lrn_file/99956_Mostcare_26_06_20.pdf?PHPSESSID=3daue72n2k16f24tvsoe56qv17
- Am J Physiol Heart Circ Physiol282: H1041–H1046, 2002.First published November 23, 2001; 10.1152/ajpheart.00764.2001.0363-6135/02 $5.00 Copyright©2002 the American Physiological Societyhttp://www.ajpheart.orgH1041 “Relation of effective arterial elastanceto arterial system properties”
- Radial pressure waveform dP/dt max is a poor indicator of left ventricular systolic function. , 37(4), 276–281. doi:10.1111/j.1365- 2362.2007.01784.x
- Pavoni et al., J Anesth Clin Res 2012, 3:8 http://dx.doi.org/10.4172/2155-6148.1000228
- https://dgk.org/daten/Dr-Reil_Ivabradin.pdf
Edwards:
PICCO
- Litton E, Morgan M. The PiCCO monitor: a review. Anaesth Intensive Care. 2012 May;40(3):393-409. doi: 10.1177/0310057X1204000304. PMID: 22577904.
- https://next.amboss.com/de/article/fM0kLg#Zdcd855cc341b397b9cb80abc02400d0e
- Die Anästhesie – Hans-Walter Striebel 3. Auflage – ISBN 978-3-7945-2942-1
- https://www.getinge.com/de/produktkatalog/picco/#Methodik
- https://www.getinge.com/siteassets/products-a-z/picco/de/picco-technology-brochure-de_r07-screen.pdf
- https://www.getinge.com/dam/hospital/documents/german/picco-q-and-a-broschuere-de-dach.pdf
- Herner A, Lahmer T, Mayr U, Rasch S, Schneider J, Schmid RM, Huber W. Transpulmonary thermodilution before and during veno-venous extra-corporeal membrane oxygenation ECMO: an observational study on a potential loss of indicator into the extra-corporeal circuit. J Clin Monit Comput. 2020 Oct;34(5):923-936. doi: 10.1007/s10877-019-00398-6. Epub 2019 Nov 5. PMID: 31691149.
- Loosen G, Conrad AM, Hagman M, Essert N, Thiel M, Luecke T, Krebs J. Transpulmonary thermodilution in patients treated with veno-venous extracorporeal membrane oxygenation. Ann Intensive Care. 2021 Jul 2;11(1):101. doi: 10.1186/s13613-021-00890-w. PMID: 34213674; PMCID: PMC8249841.
- Dufour N, Delville M, Teboul JL, Camous L, Favier du Noyer A, Richard C, Monnet X. Transpulmonary thermodilution measurements are not affected by continuous veno-venous hemofiltration at high blood pump flow. Intensive Care Med. 2012 Jul;38(7):1162-8. doi: 10.1007/s00134-012-2573-5. Epub 2012 Apr 28. PMID: 22543424.
PAK
- Navas-Blanco JR, Vaidyanathan A, Blanco PT, Modak RK. CON: Pulmonary artery catheter use should be forgone in modern clinical practice. Ann Card Anaesth 2021;24:8-11.
- Sarkar M, Umbarkar S. Pulmonary artery catheter – Dilemma is still on? Ann Card Anaesth 2021;24:1-3.
- S3-Leitlinie zur intensivmedizinischen Versorgung herzchirurgischer Patienten
Hämodynamisches Monitoring und Herz-Kreislauf (AWMF Register 001/016) - Die Anästhesie – Hans-Walter Striebel 3. Auflage – ISBN 978-3-7945-2942-1
- Das ICU-Buch – Paul L. Marino (übersetzt von Götz Geldner) – ISBN 978-3-437-23162-9
- Pinsky MR, Vincent JL. Let us use the pulmonary artery catheter correctly and only when we need it. Crit Care Med. 2005 May;33(5):1119-22. doi: 10.1097/01.ccm.0000163238.64905.56. PMID: 15891346.
Allgemein
- S3- Leitlinie: https://www.awmf.org/uploads/tx_szleitlinien/001-020l_S3_Intravasale-Volumentherapie-Erwachsene_2020-10.pdf
- Benes J, Chytra I, Altmann P, et al. Intraoperative fluid optimization using stroke volume variation in high risk surgical patients: results of prospective randomized study. Crit Care. 2010;14(3):R118. doi:10.1186/cc9070 (Algorithmus Hämodynamik).




Grüezi aus der Schweiz 🙂
Hervorragendes Post!
Bisher habe ich nur bei https://derangedphysiology.com/ darüber gelesen. Ich fande es eigentlich sehr schön erklärt. Nun hier auf Deutsch. Danke!!
Es ist sicher kompliziert, solche Konzepten zu vereinfachen. Jetzt kann ich meine IBS rotation mit einem kleinen Handbuch entgegenstellen.
LG
Lieber Alejandro,
vielen Dank für deine Rückmeldung!
Grüße gehen raus in die Schweiz von den Pin-up-docs,
Dana 🙂
Vielen Dank für diesen hervorragenden Artikel. Dass darin immense Arbeit steckt, wird sofort klar!!
Eine kleine Korrektur: DIe Einheit des vaskulären Widerstandes (dyn*s/cm^5) entspricht NICHT der W.E. – zur Umrechnug in mmHg*min/l braucht es einen Korrekturfaktor von ca. 80.
Das war unsauber formuliert, sorry. Es gilt [dyn*s/cm^5]=80*[mmHg*l/min]
Hallo Timo, erstmal: Vielen Dank für dein genaues Lesen und deine positive Rückmeldung!! =)
Du hast natürlich vollkommen recht. Den Korrekturfaktor hatte ich unabsichtlich unterschlagen und sofort im Text korrigiert! Ganz lieben Dank auch dafür!
Korrekt lautet es also:
Wood-Einheiten ≙ mmHg/l/min/m²
–> 80 x mmHg/l/min/m² ≙ dyn*s*cm^(-5). Es gibt aber durchaus auch Autor*innen, die in dieser Umwandlung keinerlei Vorteile sehen, außer, dass es aktuell wohl gebräuchlicher scheint.
Ganz liebe Grüße von den Pin-up-docs,
Dana 🙂
Hi Dana,
vielen vielen Dank für diesen großartigen Artikel.
Hätte ich das mal früher gehabt, als ich im zweiten Weiterbildungsjahr bei Halbsitzenden Kopf-OPs im Saal stand, mich zwar gefreut habe, einen PAK legen zu dürfen aber danach keine Ahnung hatte, an welchem der vielen Werte ich jetzt die Luftembolie erkenne.
(genau das ist ja eigentlich der zu vermeidende Fall: Riesen Komplikationsrisiko und dann kein Nutzen weil ahnungslose Anwenderin – Gottseidank gab’s zusätzlich noch nen präkordialen Doppler und eine TEE-Sonde)
Weiter so, alle zusammen, durch euch hab ich keine Angst vor Prüfungen mehr!
Liebste Grüße aus dem Süden,
Verena
Hallo Verena,
ganz lieben Dank für dein Feedback. Oft merke ich aus einer Situation heraus, dass ich von etwas noch nicht genug weiß, obwohl ich es anwende.. So entstehen einige meiner Artikel, an denen ich dann alle, die es ebenfalls interessiert, gern teilhaben lasse 🙂 Kenne das Gefühl das Du beschreibst also auch ! 😉
Herzlichste Grüße aus Mittelhessen,
Dana
Pingback: "titriert" Hämodynamisches Monitoring - pin-up-docs - don't panic
Pingback: Nierenerkrankung - Chronic Kidney Disease in der Anästhesiologie - pin-up-docs - don't panic
Da gibt’s vielleicht noch einen bettseitig per Ultraschall erhebbaren Parameter, der hier (schlag mich wenn es anders ist) nicht erwähnt wird. Von Zhao und Kollegen wird der IVCCI (inferior vena cava collapsibility index) beschrieben (http://www.ncbi.nlm.nih.gov/pubmed/27762259). Das geht am besten im M-Mode. Gemessen werden dabei der IVCDmax und der IVCDmin. Der Index wird in Prozent angegeben. Formel: 𝐼𝑉𝐶𝐶𝐼=(𝐼𝑉𝐶𝑚𝑎𝑥−𝐼𝑉𝐶𝑚𝑖𝑛))/𝐼𝑉𝐶𝑚𝑎𝑥 ∗100%. Werte über 12,9% können nach Zhao als Prädiktor für den Erfolg eines Volumenbolus betrachtet werden.
Der Link zur Quelle (Steinfeldt) doi:10.1186/cc9070 führt ins Leere.
Danke für den Hinweis. Haben den Fehler behoben.
Urpsungsquelle:
Benes J, Chytra I, Altmann P, Hluchy M, Kasal E, Svitak R, Pradl R, Stepan M. Intraoperative fluid optimization using stroke volume variation in high risk surgical patients: results of prospective randomized study. Crit Care. 2010;14(3):R118. doi: 10.1186/cc9070. Epub 2010 Jun 16. PMID: 20553586; PMCID: PMC2911766.
LG
Dana
Pingback: Podcastfolge 66 - Hauptfolge Juli 2024 - pin-up-docs - don't panic