Perioperatives Temperaturmanagement

Wir Anästhesist*innen werden ja gerne mal als Vitalwertemechaniker*innen bezeichnet oder bezeichnen uns vielleicht sogar selbst so. Egal wie man zu diesem mehr oder weniger rühmlichen Titel steht, muss man leider sagen, dass wir einen Vitalwert gerne unter den Tisch fallen lassen:
Die Temperatur
Und das, obwohl es sich um eines der ältesten erhobenen Vitalwerte handelt.
Wie bei allen anderen Vitalwerten auch, ist es auch bei der Temperatur wichtig, dass wir uns in einem gewissen „Optimum“ bewegen. Abweichungen aus diesem Bereich haben direkten Einfluss auf das operative Outcome. Dies liegt zu einem Großteil darin begründet, dass einige durchaus wichtige biochemische und enzymatische Prozesse nur in diesem Bereich optimal funktionieren.
Leider ist die Inzidenz für eine Hypothermie im Rahmen eines chirurgischen Eingriffs zu Teil erschreckend hoch (90 % [1]).
Im Folgenden wollen wir euch einen Einblick in die Physiologie und Pathophysiologie der Temperatur vermitteln und Tipps und Tricks für ein gutes perioperatives Management an die Hand geben.
Physiologie
Definition Normothermie
Es ist sehr schwierig DER Normaltemperatur eine Nummer zu geben. Jedes Organ hat seine eigene „Wohlfühltemperatur“. Diese ist hauptsächlich von der Durchblutung und Stoffwechselaktivität abhängig. Die metabolisch aktive Leber weist zum Beispiel eine Temperatur von 41 °C auf. Unsere Extremitäten hingegen sind insbesondere unter kühlen Umgebungstemperaturen 2-4 °C kälter als der Körperkern [3].
Außerdem variiert die Körpertemperatur im Verlauf eines Tages (zirkadianer Rhythmus). Der Höchstwert liegt zwischen 16:00 und 18:00 und das Minimum ca. um 04:00. Bei Frauen ist die Körpertemperatur zu dem zyklusabhängig und variiert um bis zu 0,5 °C.
Weitere Faktoren, die die Körperkerntemperatur beeinflussen, sind:
- körperliche Aktivität
- Infektionen
- Schilddrüsenüberfunktion / Schilddrüsenunterfunktion
- Medikamente
- Nahrungsaufnahme
Definition Hypo- / Hyperthermie
Von einer Hypothermie sprechen wir ab einer ab einer Körperkerntemperatur von < 36,0 °C [Leitlinie Perioperative Hypothermie].
Die einheitliche Definition einer Hyperthermie ist deutlich schwieriger und in der perioperativen Phase weniger relevant.
Thermoregulation
Afferenzen
Die Temperatursensoren sitzen in diversen Organen.
- Hypothalamus
- andere Teile des Gehirns
- Rückenmark
- thorakale und abdominielle Organe
- Haut
Nerdwissen: Kälte wird über dünn myelinisierte Aδ-Fasern geleitet; Wärme über unmyelinisiert C-Fasern
Schaltzentrale
Die Verarbeitung der Temperatursignale erfolgt im Hypothalamus. Hier findet ein Abgleich von „Ist-Temperatur“ mit der „Soll-Temperatur“ statt und es folgt ggf. eine Reaktion darauf.
Efferenzen
Autonome Reaktionen bei Kälte:
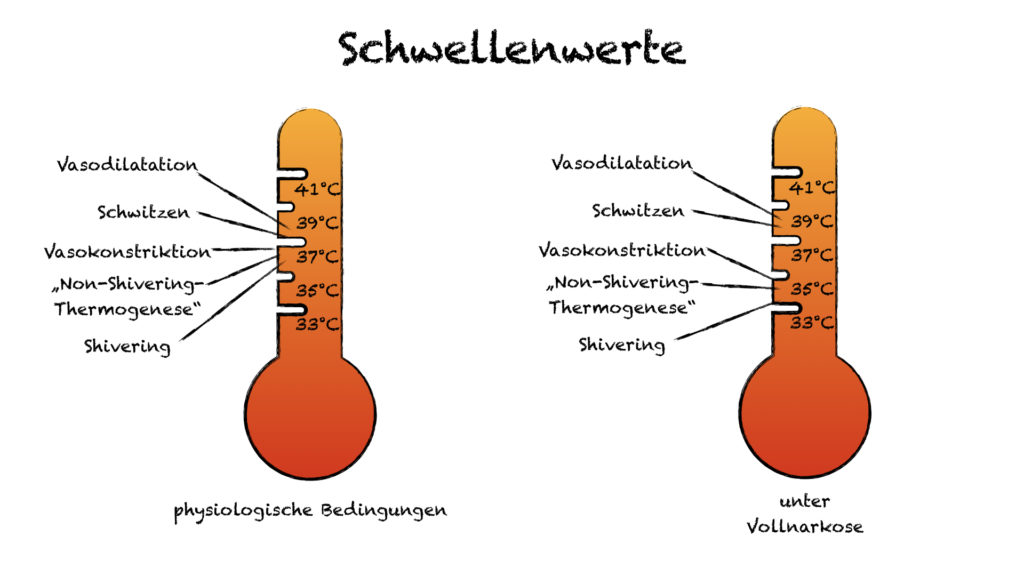
Jede Reaktion hat seine eigene Schwelle. So werden Energie effizientere Mechanismen wie die Vasokonstriktion erst ausgeschöpft bevor „kostenintensive“ Mechanismen wie Kältezittern aktiviert werden.
- Vasokonstriktion (der Feind des peripheren Zugangs)
- „Non-Shivering-Thermogenese“
- Wärmeproduktion ohne mechanische Reaktion
- geringer Effekt beim Erwachsenen
- im braunen Fettgewebe und er Skelettmuskulatur
- vermittelt über Noradrenalin
- „Shivering“ – Kältezittern
Autonome Reaktionen bei Wärme
- Vasodilatation
- Schwitzen
Verhaltensänderung
Die Verhaltensänderung ist die „mächtigste“ Stellschraube. Wir können uns etwas warmes anziehen, in den Schatten gehen, ein Bad nehmen (wahlweise temperiert), ein entsprechend temperiertes Getränk zu uns nehmen, einfach unseren Aufenthaltsort ändern oder oder oder. Im Gegensatz zu den autonomen Reaktionen, bei denen jede Afferenz ungefähr gleich gewichtet ist, wird die Verhaltensänderung zu ca. 50 % von der Hauttemperatur bestimmt. Sie erfordert zudem Bewusstsein und die Kontrolle über unseren Körper [2].
Thermoneutrale Zone
Die Thermoneutrale Zone ist die Temperatur, bei der junge gesunde Menschen ihre Körpertemperatur ohne Energieverbrauch oberhalb der Basalrate stabil halten können. Für einen aufrechtstehenden nackten Mann bei Windstille beträgt diese Temperatur 25 – 30 °C. Alter, Geschlecht, Kleidung und BMI führen zu einer Verschiebung dieser Temperatur [7].
Wärmetransport
Wenn wir uns über Temperatur Management unterhalten, sollten wir uns auch die Mechanismen des Wärmetransportes noch einmal bewusst machen:
- Konduktion: Transport über ein ruhendes Medium (z. B. Abkühlung durch Kontakt mit einer kühlen Oberfläche)
- Konvektion: Transport über ein leitendes Medium, das selbst in Bewegung ist (z. B. Wind bzw. laminarer Luftstrom im OP)
- Radiation: Wärmeabgabe durch Infrarotstrahlung (erfolgt ohne Medium – also auch im Vakuum ;))
- Evaporation: Wärmeabgabe über die Verdunstungswärme von Wasser bei der Schweißbildung
Folgen perioperativer Hypothermie
Eine ganze Reihe von Studien konnte nachweisen, dass eine perioperative Hypothermie das Outcome des Patienten verschlechtert.
- erhöhte Letalität
- (KKT ˂ 36°C: OR 2,093, 95 % CI 1,704-2,570 und KKT ˂ 35 °C: OR 2,945, 95 % CI 2,166-4,004) [4]
- Gerinnungsstörungen [5]
- vermehrte Blutverluste [5]
- Wundheilungsstörungen und Wundinfektionen [Leitlinie Perioperative Hypothermie]
- Kältezittern (Shivering) [6]
Perioperative Thermoregulation
Während der Anästhesie ergeben sich einige relevante Änderungen in der Thermoregulation.
Zum Beispiel ist die Verhaltensänderung ausgeschaltet – bei der Vollnarkose einfach aufgrund der von uns erzeugten Hypnose, bei der Regionalanästhesie aufgrund limitierter Möglichkeiten (besonders, wenn die Operateur*innen frostige Temperaturen bevorzugen) sich zu bewegen.
Im Rahmen einer OP haben Radiation und Konvektion den größten Anteil an Wärmeübertragung, also meistens Wärmeverlust.
Vollnarkose
Unsere Patient*innen sind auf die autonome Thermoregulation angewiesen. Leider wird aber auch diese durch die von uns eingesetzten Pharmaka beeinflusst. Der Schwellenwert für die autonome Thermoregulationsreaktionen wird unter Vollnarkose um 2-4 °C verschoben. Außerdem vermindern viele der von uns eingesetzten Medikamente die metabolische Wärmeproduktion um 20-30 % [2].
Perioperative Hypothermien verlaufen in meist 3 Phasen. In der Anfangsphase (1-1,5h) führen die von uns eingesetzten Medikamente zu einer Vasodilatation („Narkose macht gute Venen“). Dies führt zu einer raschen Umverteilung. Das „warme“ Blut aus dem Körperkern gelangt in die Peripherie und das „kühle“ Blut aus der Peripherie gelangt zum Körperkern. Im Anschluss (2 – 2,5h) erfolgt ein weiterer linearer Abfall, da der Wärmeverlust die Wärmeproduktion übertrifft. Dauert der Wärmeverlust weiter an, bleibt die Körperkerntemperatur durch die nun wieder einsetzende Thermoregulation auf einem niedrigeren Niveau (33 – 34 °C) konstant [2; Leitlinie Perioperative Hypothermie].
Schwitzen ist die autonome Reaktion, die am besten erhalten bleibt. Der Schwellenwert ist lediglich ein wenig erhöht [2].
Regionalanästhesie
Bei der Regionalanästhesie (besonders bei der rückenmarksnahen) kommt es ebenfalls zu Veränderungen. So ist die Temperaturwahrnehmung im anästhesierten Bereich ausgeschaltet. Außerdem kommt es in den betäubten Bereichen zu einer Vasodilatation und auch Shivering als Kompensationsmechanismus funktioniert nicht. Das Ausmaß der Beeinflussung ist damit abhängig von den betäubten Segmenten [2].
Risikofaktoren für intraoperative Hypothermie
Um die Patient*innen zu identifizieren, die besonders gefährdet sind, sollten wir uns die Risikofaktoren bewusst machen. Jeder einzelne Risikofaktor hat nur einen geringen und unterschiedlich gewichteten Einfluss auf die Körpertemperatur. Allerdings liegen häufig Kombinationen aus unterschiedlichen Faktoren vor.
Patientenbezogene Risikofaktoren
- Alter > 60 Jahre
- ASA > 1
- je höher, desto gravierender
- erniedrigtes Körpergewicht
- Evidenz hauptsächlich für Intensivpatienten
- Diabetes mellitus mit diabetischer Neuropathie
- präoperative Körperkerntemperatur < 36 °C
Anästhesie- und Operationsbezogene Risikofaktoren
- kombinierte Allgemein- und Regionalanästhesie
- Anästhesie- und Operationsdauer >2 Stunden
- hohe spinale Blockade bei rückenmarksnaher Regionalanästhesie
- hohe Infusionsvolumina
- Größe des chirurgischen Eingriffs
- hohe Volumina an Spülflüssigkeit
- Transfusion ungewärmter Blutkonserven
Perioperative Temperaturmessung
Bei wem sollten wir Temperatur messen?
Die Temperatur ist ein Vitalparameter !!!11!!1! Wie jeden anderen Vitalparameter sollten wir diesen auch bestimmten. Insbesondere wenn wir eine Veränderung bei diesem Vitalparameter erwarten.
Veränderungen erwarten wir im Rahmen der oben beschriebenen Umverteilung bei nahezu jedem Patienten, insbesondere aber ab einer Narkosedauer von > 30 min (die wir ja häufig schon erreichen, bevor jemand „Schnitt“ sagt)[2]. Ich persönlich finde es zudem inkonsequent einen Patienten zu wärmen (also den Vitalparameter zu beeinflussen) ohne den Effekt auch zu messen.
Die Temperatur sollte auch bei einer Regionalanästhesie (insbesondere bei rückenmarksnahen Verfahren) bestimmt werden.
Wann sollten wir die Temperatur messen?
Idealerweise sollte die erste Temperaturmessung 1-2 Stunden VOR Narkoseeinleitung bestimmt werden [Leitlinie Perioperative Hypothermie].
Während der Anästhesie sollte die Messung kontinuierlich oder mindestens alle 15 min erfolgen. [2; Leitlinie Perioperative Hypothermie].
Wo sollte die Temperatur gemessen werden?
Wie fast immer in der Medizin sollten wir die am wenigsten invasive Methode wählen, die zuverlässige Ergebnisse liefert.
Der Goldstandard ist die A. pulmonalis, wo das Blut der oberen und unteren Körperhälfte vollständig durchmischt ist. Dieser Ort ist leider wenig zugänglich und in der klinischen Praxis nicht möglich. Pulmonaliskatheter für alle ;)!
Wache Patient*innen
Bei wachen Patient*innen sollte die Messung sublingual erfolgen. Sublingual gemessene Temperaturen sind gut reproduzierbar und korrelieren gut mit der Körperkerntemperatur (A. Pulmonalis) [9]. Allerdings sind auch hier einige Fallstricke zu beachten. Der korrekte Messpunkt ist in der hinteren sublingual Tasche. Außerdem muss der Patient in der Lage sein, mit geschlossenem Mund zu atmen und sollte 20 min vorher nichts gegessen oder getrunken haben [2; Leitlinie Perioperative Hypothermie].
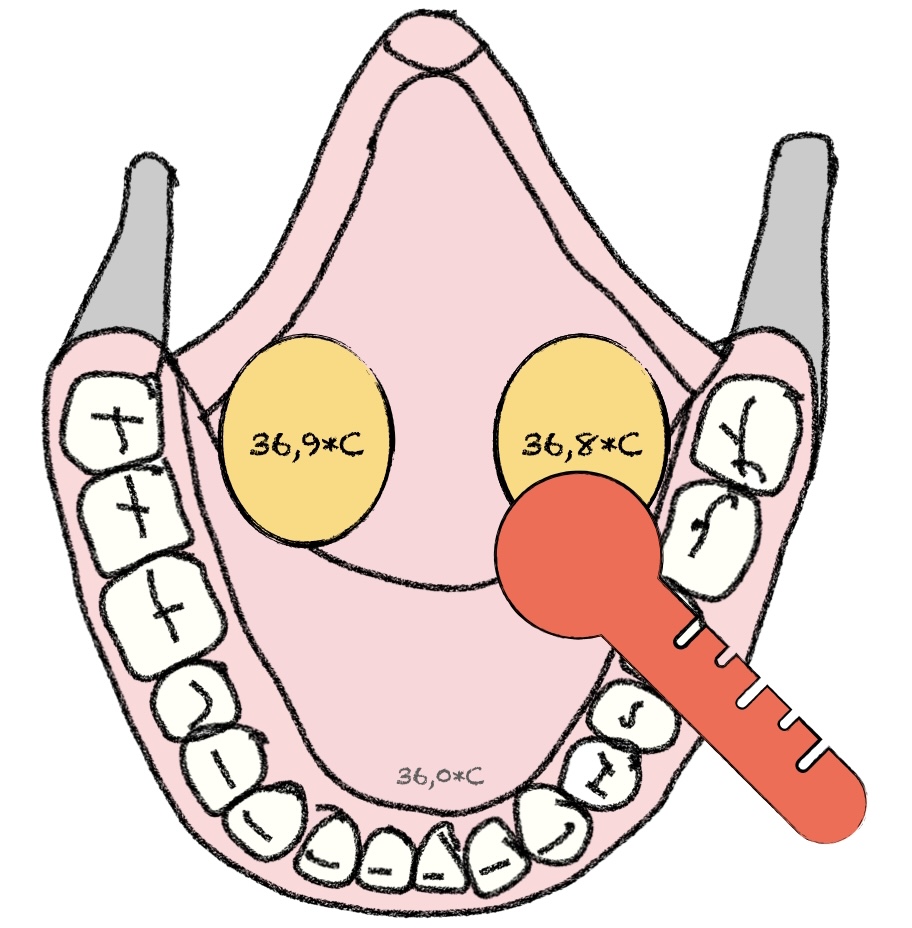
Die rektale Messung wird für Erwachsene explizit nicht empfohlen. Zum einen kann aufgrund der Fäzes eine erhöhte (im Vergleich zur A. pulmonalis) rektale Temperatur vorliegen, zum anderen besteht eine erhöhte Komplikationsgefahr [2; 9; Leitlinie Perioperative Hypothermie].
Die mittlerweile häufige aurikuläre Infrarotmessung wird ebenfalls nicht empfohlen, da es zu häufigen Fehlmessungen führt [2; 9; Leitlinie Perioperative Hypothermie].
Auch bei der der axillären Messung treten zum Teil erhebliche Messungenauigkeiten auf. Daher kann diese ebenfalls nicht empfohlen werden [2; 9; Leitlinie Perioperative Hypothermie].
Narkotisierte Patient*innen
Der richtige Messort ist auch vom OP-Gebiet abhängig. So macht es Sinn, einen Messort zu wählen, der der möglichst weit vom OP-Gebiet entfernt ist.
Die kontinuierliche oro- oder nasopharyngeale Messung, aber auch die Messung im distalen Ösophagus ist ausreichend genau und kann intraoperativ einfach durchgeführt werden.
Alternativ ist die vesikale Messung möglich. Hier sollten Temperaturabweichungen durch Spüllösungen bedacht werden. Auch eine gesteigerte Harnproduktion kann zu Temperaturabweichungen führen.
Neuere Verfahren, wie Klebesensoren auf der Stirn scheinen gute Ergebnisse zu liefern, sind aber mit erhöhten Kosten verbunden.
Wärmeerhalt und -zufuhr
Präooperativ
Prewarming
Beim Prewarming geht es nicht darum, die Körperkerntemperatur vor der OP zu erhöhen. Zum einen würde dies viel Energie benötigen, zum anderen würden wir (unerwünschte) Regulationsmechanismen wie Schwitzen aktivieren. Durch das Prewarming wollen wir viel mehr die Temperatur in den peripheren Körperabschnitten erhöhen, damit es nicht zu einem Abfall der Körperkerntemperatur durch die initiale Umverteilung kommt.
Um einen größtmöglichen Effekt zu erreichen, sollte eine aktive Wärmung (38 °C) mittels Konvektion über 30 min (mindestens 10 min) vor Beginn der Anästhesie unabhängig vom eingesetzten Verfahren begonnen werden [2; 10; Leitlinie Perioperative Hypothermie].
Intraoperativ
Keines der hier genannten Verfahren ist alleine in der Lage, den Patienten normotherm zu halten, es sollten immer mehrere Verfahren kombiniert werden.
Saaltemperatur
Analog zur thermoneutralen Zone müsste unser OP Saal 26 °C haben, damit wir auf eine zusätzliche Wärmung verzichten könnten. Was unsere Patient*innen (und wir Anästhesist*innen) vielleicht als angenehm empfinden, wird vom übrigen OP-Personal als unangenehm wahrgenommen. Temperaturen unter 21 °C hingegen stellen einen Risikofaktor für eine Hypothermie dar. Eine Saal-Temperatur von 21 °C erweist sich als sinnvoller Kompromiss.
Allerdings muss man zugeben, dass die Saaltemperatur vernachlässigt werden kann, wenn eine aktive Wärmung erfolgt [11].
passiver Wärmeerhalt
Decken oder Tücher sind die einfachste Form der Hypothermieprophylaxe. Leider sind sie als alleinige Maßnahme insuffizient. Eine einzelne Decke vermindert den Wärmeverlust und ca. 30 %. Zusätzliche Decken erhöhen diese Rate leider nur minimal [2]. Auch wenn ein alleiniger Einsatz nicht sinnvoll erscheint, sollten die Körperbereiche, die nicht gewärmt werden können, abgedeckt werden, um einen Wärmeverlust zu vermeiden.
aktive Wärmung
Prinzipiell lassen sich konvektive (Gebläse) und konduktive (Heizmatten) Wärmesystem unterscheiden. Aus theoretischen Überlegungen sind konduktive Verfahren zwar effektiver, allerdings ist hierfür ein flächiger Kontakt mit der Haut erforderlich. Beim realen Einsatz haben sich beide Wärmesystem als effektiv erwiesen. Für beide Verfahren ist wichtig, dass die Effektivität direkt von der bedeckten Fläche abhängt. [2] Eine weitere Gemeinsamkeit ist, dass zwingend (wie bei jedem Medizinprodukt) auf eine sachgerechte Anwendung zu achten ist, da sonst die Gefahr von Verbrennungen besteht (z. B. direkter Hautkontakt mit der Kunststoffdüse).
Die häufig erwähnte Erhöhung der Keimzahl im OP-Gebiet durch konvektive Wärme ist bisher nicht bewiesen. Es gibt allerdings mehrere Studien, die keine erhöhte Keimbelastung [12-14] oder keine erhöhte Infektionsrate nachweisen konnten.
Wassermatten oder Anzüge sind ebenfalls sehr effektiv, sind aber leider sehr teuer und daher nicht flächendeckend im Einsatz.
Infusionslösungen
Infusionen können ebenfalls zu einer Hypothermie führen. Dabei ist das Ausmaß sowohl von der Temperatur der verabreichten Flüssigkeit als auch von der verabreichten Infusionsmenge pro Zeiteinheit. Die Leitlinie empfiehlt eine Erwärmung von Infusionen ab einer Infusionsrate von > 500 ml pro Stunde [2; Leitlinie Perioperative Hypothermie].
Die Erwärmung (max 42 °C) von Blutprodukten ist nach der aktuellen Querschnittsleitlinie für Hämotherapie auf wenige Indikationen beschränkt:
- Massivtransfusion
- Kälteantikörper
Spüllösungen
Genau wie Infusionslösungen können auch Spüllösungen zu einer Veränderung der Körpertemperatur führen. Daher sollten alle Spüllösungen auf 38-42 °C erwärmt werden (Daher können kalte Spüllösungen im Rahmen einer malignen Hyperthermie durchaus Sinn machen). Spüllösungen für Arthroskopien scheinen keinen oder zumindest lediglich einen geringen Einfluss zu haben [Leitlinie Perioperative Hypothermie].
Atemluft
Wärmeverluste über die Atemluft sind eher gering. Nichtsdestotrotz ist die Vermeidung eines unnötigen Wärmeverlustes ein weiterer Grund (neben Umweltschutz und Kostenersparnissen) für eine Low- bzw. Minimal-Flow Narkose [2].
Postoperativ
Analog zur Vasodilatation bei Narkoseeinleitung und dem damit verbundenen Temperaturabfall tritt nach der Ausleitung eine periphere Vasokonstriktion auf (insbesondere bei hypothermen Patient*innen). Diese Vasokonstriktion macht eine Wiedererwämung deutlich schwieriger, was die Bedeutung eines guten intraoperativen Temperaturmanagements unterstreicht.
Sollte eine postoperative Wärmung notwendig sein, scheinen aktive konvektive Verfahren am effektivsten zu sein [15].
Shivering
Shivering sind unwillkürliche oszillierende Kontraktionen der Skelettmuskulatur (Kältezittern) und ist die nächste Eskalationsstufe des Körpers, falls periphere Vasokonstriktion und Verhaltensänderung keinen ausreichenden Effekt auf einen Abfall der Körpertemperatur haben. Postoperatives Shivering ist eine häufige Komplikation einer Anästhesie. Neben Schmerzen und Übelkeit stellt es eine der unangenehmen postoperativen Empfindungen dar. Die gesteigerte Muskelaktivität im Rahmen des Shivering erhöht den Sauerstoffverbrauch um bis zu 40 % [16]. Gerade bei kritischen Patient*innen kann dies zu einer Gewebshypoxie, Laktatazidose und zu erhöhten Katecholaminspiegel führen. Dies wiederum führt zu einem erhöhten Herzzeitvolumen, welches in einer erhöhten Rate von kardiovaskulären Komplikationen mündet [17].
Das Shivering tritt erst bei Ausleitung der Narkose auf, weil es durch die von uns eingesetzten Pharmaka zu einer Verschiebung der Thermoregulationsschwelle kommt. Mit Beendigung der Anästhesie schiebt sich diese Schwelle wieder in den normalen Bereich.
Ätiologisch liegt meist eine perioperative Hypothermie zugrunde. Postoperatives Shivering kann aber auch bei normothermen Patient*innen auftreten. Auch wenn die genauen Mechanismen unzureichend verstanden sind, werden folgende Mechanismen bei normothermen Shivering diskutiert:
Fieber – intraoperativ freigesetzte Botenstoffe können eine Verschiebung der „Soll-Temperatur“ im Hypothalamus zur Folge haben. Obwohl wir unsere Patient*innen normotherm gehalten haben, kommt es zum Shivering, da „Soll- und Ist-Wert“ nicht übereinstimmen.
Schmerzen und Opioidentzug – gestützt wird diese These, da Shivering bei der Anwendung von Remifentanil häufiger Auftritt als bei Fentanyl. Dies könnte mit dem raschen Abbau von Remifentanil zusammenhängen [17;18].
Prophylaxe und Therapie
Da eine Hypothermie den häufigsten Grund für ein postoperatives Shivering darstellt, ist die effektivste Methode zur Vorbeugung ein effektives intraoperatives Wärmemanagement.
Wenn es trotzdem zu einem Shivering kommt, sollte zur Vermeidung der negativen Folgen und zur Erhöhung des Patientenkomforts neben einer aktiven Wärmung eine medikamentöse Therapie erfolgen.
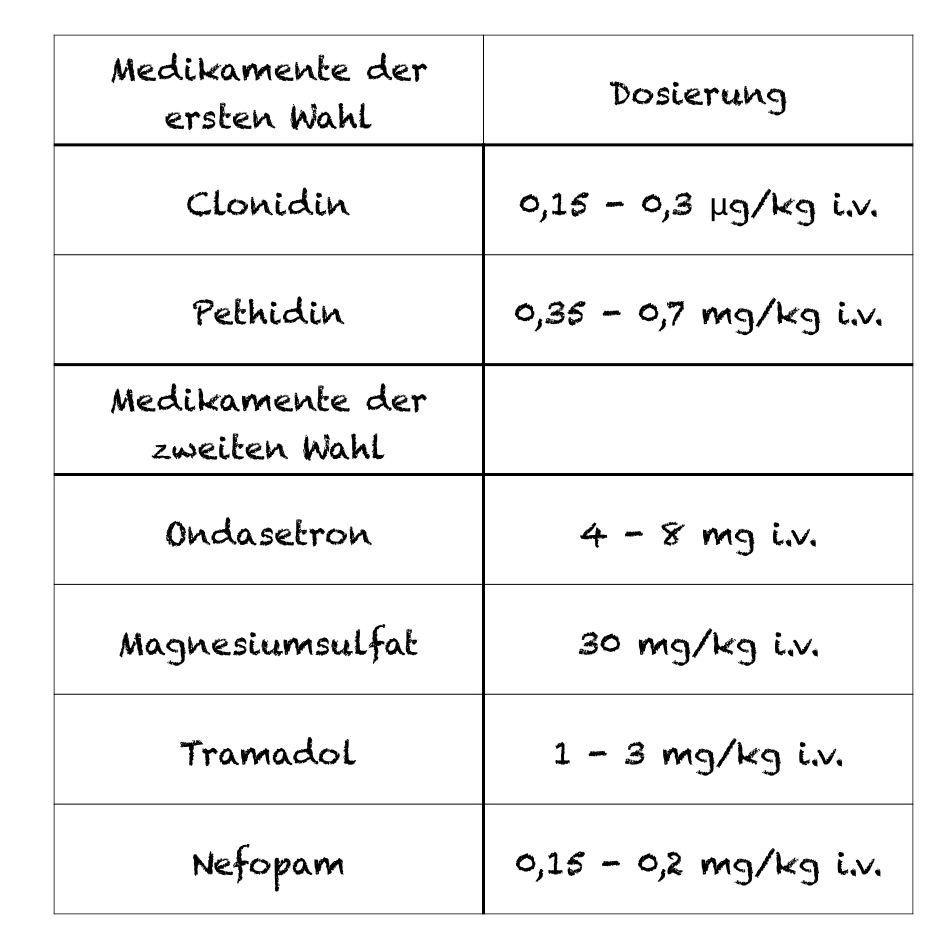
Leider gibt es kein Präparat, das zur Therapie des postoperativen Shiverings zugelassen ist, sodass es sich immer um einen „Off-Label-Use“ handelt. Nichtsdestotrotz gibt es einige erprobte Wirkstoffe, die über unterschiedliche Wirkmechnismen infrage kommen:
Opioidrezeptor-Agonist
Pethidine ist ein κ und μ-Agonist. Über die Aktivierung dieser Rezeptoren werden der Schwellenwert für Kältezittern und die „Soll-Temperatur“ herabgesetzt. Obwohl Tramadol nur eine geringe Affinität zum μ-Rezeptor und gar keine zum κ-Rezeptor hat, ist es trotzdem effektiv. Dies wird hauptsächlich über seine antagonistische Wirkung am NMDA-Rezeptor erklärt [17].
5-HT3-Antagonisten
Serotonin spielt eine wichtige Rolle in der zentralen Thermoregulation im Hypothalamus. Durch eine Inhibition der Serotonin-Wiederaufnahme können diese Wirkstoffe postoperatives Shivering verhindern. Besonders für Ondansetron (4-8 mg) konnte dieser Effekt belegt werden [19].
NMDA-Rezeptor-Antagonisten
Es konnte gezeigt werden, dass Low-Dose-Ketamin, besonders nach Remifentanil-Narkose, die Inzidenz von Shivering senkt. Leider ist der zugrunde liegende Mechanismus (neben der analgetischen und sedierenden Komponente) und nicht verstanden [20]. (Am Ende ist Ketamin ja irgendwie für alles gut.)
Magnesium
Magnesium ist sowohl ein natürlich vorkommender NMDA-Rezeptor Antagonist als auch ein mildes Muskelrelaxans. Magnesium verschiebt die Zitterschwelle zwar nur um ein paar zehntel Grad, aber das kann ja manchmal schon ausreichend sein[17].
Alpha-2-Agonisten
Alpha-2-Agonisten reduzieren zum Einen den Sympathikotonus, die periphere Vasokonstriktion und Zitterschwelle und beeinflussen zum anderen die zentrale Thermoregulation und spontane Entladungsrate von Neuronen. Sowohl Clonidin als auch Dexmedetomidin können effektiv eingesetzt werden [17; 21].
Nefopam
Nefopam ist ein zentral wirksames Analgetikum ohne narkotische, antiphlogistische und antipyretische Wirkung. Es verhindert die Wiederaufnahme verschiedener Neurotransmitter unter anderem Serotonin, Dopamin und Noradrenalin. Es ist eins der am besten untersuchten Medikamente zur Therapie des Shivering [17].
Physostigmin
Als indirektes Parasympathomimetikum verstärkt Physostigmin die Aktivität des parasympathischen Nervensystems. Über diesen Weg verhindert es ebenfalls postoperatives Shivering [17].
Weitere weniger erforschte Wirkstoffe sind Hydrokortison (wirkt ja irgendwie immer) und Coxibe.
Die aktuelle Leitlinie hat diese Medikamente im Rahmen einer Nutzen-Risiko-Analyse bewertet und empfiehlt folgende Medikamente in folgenden Dosierungen:
Punchlines

- Die Temperatur ist ein Vitalparameter !!!11!1!, der gemessen werden sollte.
- Intraoperative Hypothermien sind häufig und haben einen relevanten Einfluss auf das operative Outcome.
- Der optimale Messort ist abhängig /möglichst weit entfernt) von der durchgeführten Narkose und vom Eingriff:
- ösophageal
- vesikal
- sublingual (wacher Patient)
- Alle Patient*innen sollten gewärmt werden.
- Shivering ist häufig und meist Hypothermie bedingt.
- Es gibt verschiedene medikamentöse Optionen zur Therapie des postoperativen Shivering, die zusätzlicher aktiven Wärmung angewandt werden können.
Autor
Dr. med. Thorben Doll
Facharzt Anästhesiologie, aktiver Notarzt, lernte die Notfallmedizin von der Pike auf kennen, präklinische Erfahrung 19 Jahre und Gründer von Pin-Up-docs.de
Andere #FOAMed Quellen
Young Urban Anesthesiologists – Folge 15 – Temperatur Teil 1 mit Prof. Bräuer
Young Urban Anesthesiologists – Folge 16 – Temperatur Teil 2 mit Prof. Bräuer
Quellen
Leitlinie
Artikel
- Moola S, Lockwood C. Effectiveness of strategies for the management and/or prevention of hypothermia within the adult perioperative environment. Int J Evid Based Healthc. 2011 Dec;9(4):337-45. doi: 10.1111/j.1744-1609.2011.00227.x. PMID: 22093385.
- Bindu B, Bindra A, Rath G. Temperature management under general anesthesia: Compulsion or option. J Anaesthesiol Clin Pharmacol. 2017;33(3):306-316. doi:10.4103/joacp.JOACP_334_16
- Mackowiak PA et al. Concepts of fever: recent advances and lingering dogma. Clin Infect Dis 1997; 25:119-38.
- Kiekkas P, Fligou F, Igoumenidis M et al. Inadvertent hypothermia and mortality in critically ill adults: Systematic review and meta-analysis. Austral Crit Care 2018; 31:12-22.
- Schmied H et al. Mild hypothermia increases blood loss and transfusion requirements during total hip arthroplasty. Lancet 1996; 347:289-92.
- Alfonsi P, Nourredine KE, Adam F, Chauvin M, Sessler DI. Effect of postoperative skin-surface warming on oxygen consumption and the shivering threshold. Anaesthesia. 2003 Dec;58(12):1228-34. doi: 10.1046/j.1365-2044.2003.03444.x. PMID: 14705689; PMCID: PMC1314985.
- Mekjavic IB, Eiken O. Contribution of thermal and nonthermal factors to the regulation of body temperature in humans. J Appl Physiol. 2006;100:2065–72.
- NICE. Perioperative hypothermia (inadvertent): the management of inadvertent perioperative hypothermia in adults. NICE Clinical Guideline 65, 2008. 29; Addendum 65.1 Dec. 2016. https://www.nice.org.uk/
- Hooper, Vallire D., and Jeannette O. Andrews. „Accuracy of noninvasive core temperature measurement in acutely ill adults: the state of the science.“ Biological research for nursing 8.1 (2006): 24-34.
- Andrzejowski J, Hoyle J, Eapen G, Turnbull D. Effect of prewarming on post-induction core temperature and the incidence of inadvertent perioperative hypothermia in patients undergoing general anaesthesia. Br J Anaesth. 2008 Nov;101(5):627-31. doi: 10.1093/bja/aen272. Epub 2008 Sep 26. PMID: 18820248.
- Pei L, Huang Y, Xu Y et al. Effects of ambient temperature and forced-air warming on intraoperative core temperature: a factorial randomized trial. Anesthesiology 2018; 128:903-11.
- Oguz R, Diab-Elschahawi M, Berger J et al. Airborne bacterial contamination during orthopedic surgery: A randomized controlled pilot trial. J Clin Anesth 2017; 38:160-4.
- Shirozu K, Kai T, Setoguchi H et al. Effects of forced air warming on airflow around the operating table. Anesthesiology 2018; 128:79-84.
- Sharp RJ, Chesworth T, Fern ED. Do warming blankets increase bacterial counts in the operating field in a laminar-flow theatre? J Bone Joint Surg Br 2002; 84:486-8.
- Warttig S, Alderson P, Campbell G, Smith AF. Interventions for treating inadvertent postoperative hypothermia. Cochrane Database Syst Rev. 2014 Nov 20;(11):CD009892. doi: 10.1002/14651858.CD009892.pub2. PMID: 25411963.
- Frank SM et al. Multivariate determinants of early postoperative oxygen consumption in elderly patients. Effects of shivering, body temperature, and gender. Anesthesiology 1995; 83:241-9.
- Lopez, Maria Bermudez. “Postanaesthetic shivering – from pathophysiology to prevention.” Romanian journal of anaesthesia and intensive care vol. 25,1 (2018): 73-81. doi:10.21454/rjaic.7518.251.xum
- Röhm KD, Riechmann J, Boldt J, Suttner SW, Piper SN. Total intravenous anesthesia with propofol and remifentanil is associated with a nearly twofold higher incidence in postanesthetic shivering than desflurane-fentanyl anesthesia. Med Sci Monit. 2006 Nov;12(11):CR452-6. PMID: 17072268.
- He K, Zhao H, Zhou HC. Efficiency and safety of ondansetron in preventing postanaesthesia shivering. Ann R Coll Surg Engl. 2016 Jul;98(6):358-66. doi: 10.1308/rcsann.2016.0152. Epub 2016 May 3. PMID: 27138855; PMCID: PMC5209977.
- Nakasuji M, Nakamura M, Imanaka N, Tanaka M, Nomura M, Suh SH. An intraoperative small dose of ketamine prevents remifentanil-induced postanesthetic shivering. Anesth Analg. 2011;113:484–487. doi: 10.1213/ANE.0b013e318224ac4e
- Liu ZX, Xu FY, Liang X, Zhou M, Wu L, Wu JR, Xia JH, Zou Z. Efficacy of dexmedetomidine on postoperative shivering: a meta-analysis of clinical trials. Can J Anaesth. 2015 Jul;62(7):816-29. doi: 10.1007/s12630-015-0368-1. Epub 2015 Apr 8. PMID: 25851018.


Zum Nefopam, in Frankreich wird Nefopam sehr oft als nicht-opioid Analgetikum eingesetzt. Meistens als Zusatz zu Paracetamol bei leichten bis mittleren Schmerzen. In der Praxis wird oft die gewünschte Dosis in ner Kurzinfusion oder der Paracetamol-infusion hinzugefügt gegeben. Meist gute Wirkung, kann aber wenn zu schnell gegeben zu übelkeit führen weshalb es post-OP oft erst nach PONV Prophylaxe verabreicht wird und bei Patienten mit hohem PONV Risiko bedacht eingesetzt werden sollte.
LG von nem PJler und Anästhesie-enthusiasten aus Frankreich
Hallo Pinup Docs, bin über Springer auf diese Studie gestolpert:
https://www.springermedizin.de/operationsvorbereitung/allgemeinanaesthesie/praeoperatives-aufwaermen-passé-/20388162
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(22)00560-8/fulltext
Guckt mal rein, ich war etwas überrascht, da in meiner Weiterbildung war und ist das Prewarming ein wichtiger Bestandteil jeder Narkose.
Vielen Dank für euere Arbeit:)
Danke für deinen Kommentar
Dann hör mal unseren Mai Podcast 😉
Liebe Grüße Thorben
Kurze Spießerfrage:
Die Dosierung des Clonidins tatsächlich „nur“ 0,15-0,3 μg/kgKG? Das wären ja bei 100 kg gerade mal 30μg Clonidin und ich hätte mit 75μg als schüchterne Startdosis immer völlig überzogen…
Danke für eure tolle Arbeit!
Necco.
Hallo Nicolas,
das ist die in der gültigen Leitlinie angegebene Dosierung.
Liebe Grüße
Hallo Thorben,
das stimmt total, wie ihr das aus der Leitlinien übernommen habt. Spannenderweise wurden in den 3 Studien, die als Begründung angegeben sind, immer deutlich mehr gegeben:
– 2 µg/kg über 20min (direkt postoperativ) (n=20)
– 5 µg/kg über 3h perioperativ (n=28)
– 4 µg/kg
Eine Begründung habe ich in der Leitlinie leider nicht gefunden…
Liebe Grüße!
Pingback: "titriert" Temperaturmanagement - pin-up-docs - don't panic