Basics – Perioperatives Steroidmanagement

Die Dauertherapie mit Glucocorticoiden stellt ein etabliertes Konzept für verschiedene Krankheiten dar:
- Chronisch-entzündliche Erkrankungen:
- Asthma bronchiale
- COPD
- chronisch-entzündliche Darmerkrankungen
- Rheumatologische Erkrankungen:
- Rheumatoide Arthritis
- Sarkoidose
- Sjögren-Syndrom
- Kollagenosen
- Psoriasis-Arthritis
- Vaskulitiden
- Immunsuppression nach Transplantation
Patienten unter einer Glucocorticoid-Dauermedikation können eine sekundäre Nebennierenrindeninsuffizienz entwickeln. Gerade im Rahmen des perioperativen Stresses sind diese Patienten gefährdet, eine manifeste Addison-Krise zu entwickeln. Aber wann müssen wir handeln und vor allem wie? Diesen Fragen versuchen wir im Folgenden auf den Grund zu gehen.
Physiologie
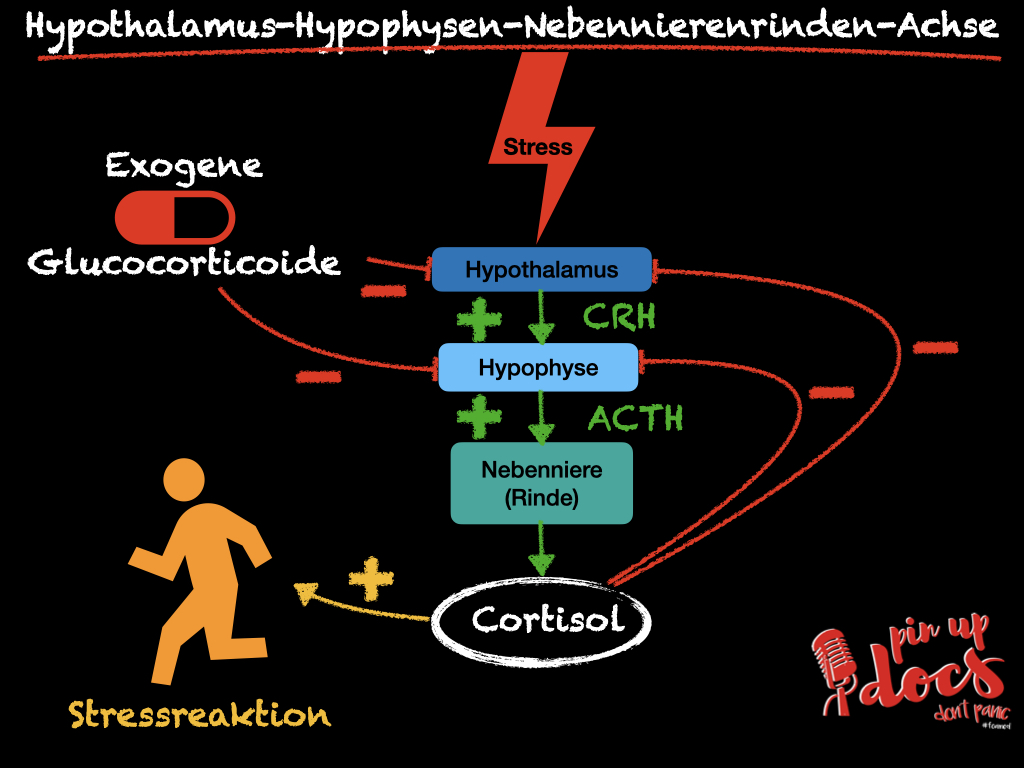
Die Hypothalamus-Hypophysen-Nebennierenrinden-Achse oder „Stressachse“ ist ein komplexer Regelkreis, der viele Prozesse im Körper beeinflusst:
- Verdauung
- Immunsystem
- Stimmung und Gefühle
- Sexualität
- Energiespeicherung und -verwendung
- Gluconeogenese
- Glykogenolyse
- Katecholaminproduktion und -wirkung
Der Hypothalamus produziert das Corticotropin-releasing Hormone (CRH; auch Corticoliberin), welches die Hypophyse stimuliert. Diese produziert ihrerseits Adrenocorticotropin (ACTH; auch Adrenocorticotropes Hormon), das dann die Nebennierenrinde anregt, Cortisol zu produzieren. Cortisol hingegen führt zu einer Hemmung des Hypothalamus und der Hypophyse (negative Rückkopplung).
Für Anästhesisten ist besonders interessant, dass Cortisol durch eine Modulation der β-Rezeptoren zu einer verstärkten Reaktion auf Katecholamine führt und somit essenziell für den Gefäßtonus und den „cardiac output“ ist (Jabbour et al.; Stoelting’s Anesthesia and Co-Existing Disease).
Pathophysiologie Nebennierenrinden-Insuffizienz
Bei Patienten mit einer Glucocorticoid-Dauertherapie kann es durch das exogen zugeführte Hormon zu einer Blockierung der CRH- und der ACTH- Produktion kommen. Dies wiederum führt zu einer Atrophie der Zona fasciculata der Nebennierenrinde und somit einer verminderten Cortisolproduktion. Dies ist die häufigste Form der sekundären Nebennierenrinden-Insuffizienz. Anders als bei primären Formen der Nebennierenrinden-Insuffizienz bleibt das Renin-Angiotensin-Aldosteron System (RAAS) intakt und es liegt kein Mangel an Mineralokortikoiden vor.
Schwellendosis
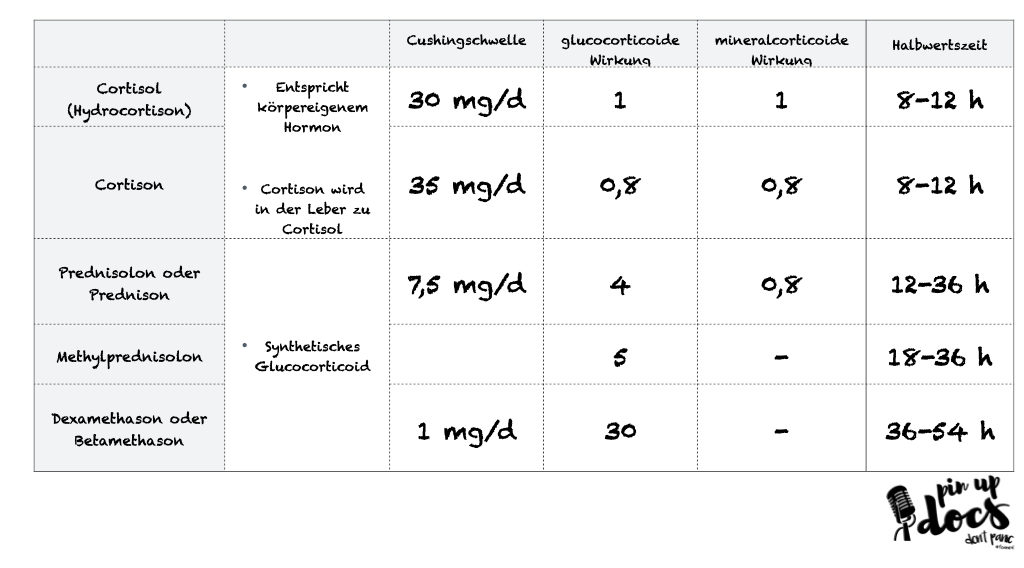
Leider lässt sich das Vorliegen einer Nebennierenrinden-Insuffizienz nur schwer vorhersagen. Das Risiko steigt mit Dauer und Dosis der Therapie. Zum Beispiel kann ein Patient mit einer durchaus höheren Tagesdosis von 20-30mg Prednisolon (vgl. Äquivanlenztabelle) bereits nach wenigen Tagen eine verminderte Produktion aufweisen (Schlaghecke et al.). Biochemische Tests zeigen leider, dass weder die Dosis noch die Dauer der Therapie eine exakte Aussage über das Ausmaß der Nebennieren-Insuffizienz erlauben.
Symptome
Patienten mit einer Glucocorticoid-Dauertherapie sind also – aufgrund ihrer verminderten Cortisolproduktion – gefährdet, eine Addison-Krise zu entwickeln. Bei wachen Patienten können wir natürlich auf Symptome für eine solche Krise achten (Bornstein et al.):
- Vigilanzstörung, Fieber
- Übelkeit und Erbrechen
- Diarrhö
- Exsikkose
- Hypotonie -> Schock
- Hypoglykämie
- Pseudoperitonitis
Beim narkotisierten Patienten fehlt uns leider die Möglichkeit, einen Großteil dieser Symptome zu beurteilen, sodass wir hellwach sein müssen, um die richtige Diagnose zu stellen.

Klinisch zeigt sich bei narkotisierten Patienten meist eine volumen- und katecholaminrefraktäre Hypotension.
Prophylaxe und Therapie
Wir Anästhesisten müssen also eine schwere Entscheidung treffen:
Eine seltene aber potentielle tödliche Komplikation behandeln
oder
die wahrscheinlich unnötige hoch dosierte Glucocorticoid-Gabe in Kauf nehmen.
Verkompliziert wird diese Situation durch eine sehr schlechte Studienlage zu diesem Thema. Die meisten Studien sind klein (ca. 20 Patienten) und die Patientenauswahl, die Art des chirurgischen Eingriffs, die Art der Anästhesie und das klinische Outcome sind uneinheitlich. Selbst der Zeitpunkt der Steroidgabe oder die Dosis sind von Studie zu Studie unterschiedlich.
Die Dauertherapie mit Glucocorticoiden erhöht das Risiko für Wundheilungsstörungen, Immunsuppression, Hyperglykämie und psychiatrische Komplikationen (Psychosen). Inwiefern eine zusätzliche Stressdosis diese Komplikationen verstärkt können wir leider nicht mit Sicherheit sagen.
In der aktuelle Leitlinie (Bornstein et al.) wird festgehalten, dass das anzunehmende Risiko einer Addison-Krise (wenn auch selten) dem Schaden einer kurzzeitigen Übertherapie überwiegt. Auch Marik et al. kommen zu dem Schluss, dass eine kurzzeitige Übertherapie besser ist als der Schaden, der durch eine Addison-Krise entsteht.
Was man mit einiger Sicherheit sagen kann:
- präoperative Plasma-Messungen sind kein geeigneter Prädiktor (Kehlet et al. ; Marik et al.)
- Schwankungen sind zu groß
- Die normale Tagesdosis der Dauermedikation sollte am Morgen vor dem Eingriff eingenommen werden (Kelly et al.; Brown et al.; Marik et al.)
Welcher Patient? – individuelles Risiko
Es bleibt also die praktische Frage: Wer profitiert von einer Glucocorticoid-„Stress-Dosis“?
Wir müssen das individuelle Risiko jedes Patienten für eine verminderte Funktion der Nebennierenrinde berücksichtigen. Vereinfacht kann man diesen einer von 3 Gruppen zuordnen:
Low Risk
- Glucocorticoid-Therapie kürzer als 3 Wochen (Dosis egal)
- weniger als 5 mg Prednisolon oder Äquivalent täglich (Dauer egal)
- weniger als 10 mg Prednisolon oder Äquivalent jeden zweiten Tag (Dauer egal)
Hier benötigen wir keine zusätzliche „Stress-Dosis“, außer die Patienten zeigen Zeichen einer Addison-Krise (Vasoplegie).
High Risk
- mehr als 20 mg Prednisolon oder Äquivalent täglich über mehr als 3 Wochen
- klinische Zeichen einer Nebenniereninsuffizienz
- nachgewiesene Nebenniereninsuffizienz
Diese Patienten haben eine hohe Wahrscheinlichkeit für eine supprimierte Nebennierenrindenfunktion und profitieren somit mit hoher Wahrscheinlichkeit von einer „Stress-Dosis“.
Intermediate Risk
- alle Patienten, die sich weder der High Risk- noch der Low Risk-Gruppe zuordnen lassen
Diese sind wie immer die schwierigsten Patienten, da wir eine individuelle Entscheidung treffen müssen. Diese Entscheidung sollte folgende Faktoren berücksichtigen:
- körperliche Untersuchung
- Zeichen eines Cushing-Syndroms?
- chirurgisches Risiko
- perioperativer Patientenzustand
Es ist aus unserer Sicht statthaft, bei einem ansonsten gesunden Patienten die „Stress-Dosis“ zurück zu halten, bis es zu Zeichen einer Insuffizienz (hämodynamische Instabilität) kommt. Ebenso ist eine prophylaktische Gabe bei ASA 3-4 Patienten mit hohen präoperativen Steroiddosen statthaft.
Welche OP? – operatives Risiko
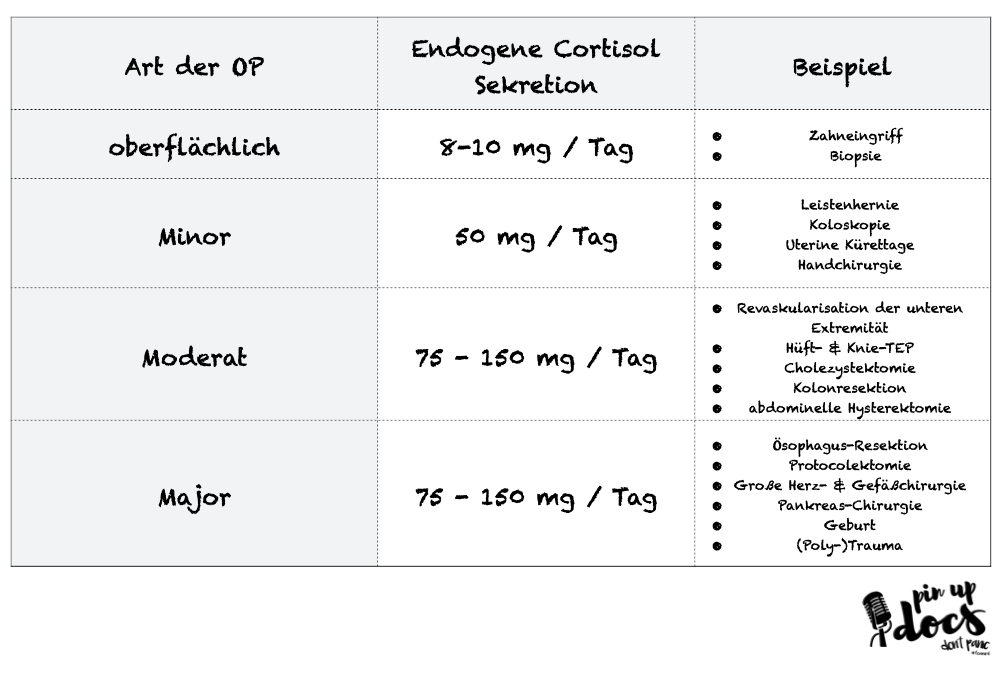
Als wenn das nicht schon reichen würde, verursachen operative Eingriffe je nach Dauer, beteiligten Organsystemen und Gewebsschaden ein unterschiedliches Maß an „Stress“ und können somit ein unterschiedliches Maß an endogenem Cortisol-Bedarf zur Folge haben:
Wie? – Substitutionsstrategie
Wir haben also nun geklärt, welchen Patienten wir bei welcher OP substituieren. Jetzt müssen wir uns Gedanken darüber machen, wie wir das Cortisol-Defizit ausgleichen. Das Mittel der Wahl ist in diesem Fall Hydrocortison (Stoelting’s Anesthesia; Axelrod et al.; Hamrahian UpToDate). Wir sollten uns allerdings bewusst machen, dass die sekundäre Nebennierenrindeninsuffizienz ein Defizit an Glucocorticoiden und nicht an Mineralocorticoiden darstellt. Die mineralocorticoide Wirkung einer Substanz muss also berücksichtig werden, da es sonst zu einem Überschuss an Mineralocorticoiden mit den entsprechenden Symptomen kommen kann:
- Ödeme / Volumenretention
- Hypokaliämie
In diesem Zusammenhang kann es Sinn machen, bei hohen nötigen Dosierungen von Hydrocortison (>100 mg) auf Methylprednisolon zu wechseln, da es eine geringere mineralocorticoide Wirkung hat (Stoelting’s Anesthesia; Axelrod et al.).
Das von uns bevorzugte Dosierungsschema lautet:
oberflächliche Chirurgie:
normale Tagesdosis
Minor Chirurgie:
normale Tagesdosis + 50 mg Hydrocortison vor dem Schnitt + 25 mg alle 8h für 24h
Moderate Chirurgie:
normale Tagesdosis + 50 mg Hydrocortison vor dem Schnitt + 25 mg alle 8h für 24h
Major Chirurgie:
normale Tagesdosis + 100 mg Hydrocortison vor dem Schnitt + 200 mg Perfusor über 24h. Im Anschluss 100 mg Perfusor in den nächsten 24h -> dann wieder normale Tagesdosis

Punchlines

- Patienten unter Steroid-Dauertherapie sollten perioperativ ihre normale Tagesdosis erhalten
- bei klinischen Zeichen einer NNRI oder High Risk Patienten überwiegt das anzunehmende Risiko einer Addison-Krise dem Schaden einer kurzzeitigen Übertherapie
- Wenn eine „Stress-Dosis“ erfolgt, sollte diese am operativen Risiko bemessen werden
Autoren
Dr. med. Thorben Doll
Arzt in Weiterbildung Anästhesiologie, aktiver Notarzt, lernte die Notfallmedizin von der Pike auf kennen, präklinische Erfahrung 17 Jahre und Gründer von Pin-Up- Docs.de
Johannes Pott
Arzt in Weiterbildung Anästhesiologie, aktiver Notarzt, Lieblingsbaustelle ist die Intensivstation. Seit 16 Jahren im Rettungsdienst und Gründer von Pin-Up-Docs.de

Online Quellen
https://flexikon.doccheck.com/de/Renin-Angiotensin-Aldosteron-System
https://flexikon.doccheck.com/de/Hypothalamus-Hypophysen-Nebennierenrinden-Achse
https://flexikon.doccheck.com/de/Nebenniereninsuffizienz
Quellen
Jabbour SA: Steroids and the surgical patient. Med Clin North Am 2001; 85:1311–7
Kelly KN, Domajnko B: Perioperative stress-dose steroids. Clin Colon Rectal Surg 2013; 26:163–7
Hamrahian AH, Roman S, Milan S: The management of the surgical patient taking glucocorticoids. Edited by Nieman LK, Carty SE, Martin KA, Chen W UpToDate. Available at: http://www.uptodate.com/contents/the-surgical-patient-taking-glucocorticoids. Accessed December 10, 2015


Pingback: "titriert" perioperatives Steroid-Management - pin-up-docs - don't panic
Meine Frage: Unter welche Risiko Gruppe fallen Pat. mit Z.n. bilateraler Adrenalektomie?
Meiner Meinung nach „High Risk“
Danke für die Antwort
Christoph Schrempf
Hallo Christoph,
Patienten nach bilateraler Adrenektomie haben gar keine endogene Cortisonproduktion mehr und sind auf exogenes Kortison angewiesen. Daher definitiv „High Risk“
Liebe Grüße
Thorben
Was spricht denn gegen eine perioperative Substitution mit Dexamethason? 8 mg entsprechen ja theoretisch 240 mg Hydrokortison, zudem liegt (gewünschterweise) keine Mineralokortikoide Wirkung vor und wir geben es ja sowieso gerne zur PONV-Prophylaxe. Durch die lange Wirkung könnte ja eine Applikation ausreichen, also kein Auschleichen und es wäre somit extrem einfach anzuwenden. Vielleicht spricht am ehesten der verzögerte Wirkungseintritt dagegen.
Hallo Andreas,
Vielen Dank für deinen Kommentar. Wir teilen deine Überlegungen zu 100%. Allerdings gibt es zu Dexa als Stressprophylaxe keinerlei Studien. Daher fällt es schwer eine generelle Empfehlung auszusprechen. Der verzögerte Wirkeintritt ist denke ich eher ein theoretisches Problem. Fazit: Theoretisch völlig richtig, ABER nicht untersucht.
Liebe Grüße
Thorben
Hi, wie würde man Vorgehen bei einem Patienten, der bis vor 2 Wochen 8 Wochen lang 20mg Prednison tgl. eingenommen hat ?
Achtet man da vor allem auf die Klinik oder würde der Patient eine Stressprophylaxe bekommen ? wenn ja in welcher Dosierung?
Liebe Grüsse
Rebecca
Hallo Rebecca,
vielen Dank für deinen Kommentar. Ich glaube, dass sich diese Frage normalerweise nicht stellen sollte:
Wenn ein Patient längerfristig >= 20 mg Predni pro Tag genommen hat, sollte dieses langsam ausgeschlichen werden (Normalerweise 5mg pro Woche weniger) um die Nebennierenrinde wieder an Ihre Aufgabe zu gewöhnen.
Wenn jemand 20mg tatsächlich einfach abgesetzt hat, würde ich es von der Klinik abhängig machen